部分弱电解质的电离平衡常数如下表:
| 弱电解质 |
HCOOH |
HCN |
H2CO3 |
NH3·H2O |
| 电离平衡常数 (25 ℃) |
Ka=1.8×10-4 |
Ka=4.9×10-10 |
Ka1=4.3×10-7 Ka2=5.6×10-11 |
Kb=1.8×10-5 |
下列说法不正确的是
A.结合H+的能力:CO32->CN->HCO3->HCOO-
B.0.1mol/L的HCOONH4溶液中:c(HCOO-)>c(NH4+)>c(H+)>c(OH-)
C.25 ℃时,pH=3的盐酸与pH=11的氨水混合,若溶液显中性,则二者消耗的体积是:V(盐酸)>V(氨水)
D.0.1mol/L的NaHCO3溶液中:c(Na+)+ c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
用NA表示阿伏加德罗常数,下列叙述正确的是()
| A.标准状况下,22.4L H2O含有的分子数为1 NA |
| B.常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA |
| C.常温常压下,1 NA个CO2分子占有的体积为22.4L |
| D.物质的量浓度为0.5mol / L的MgCl2溶液中,含有Cl-物质的量浓度为1 mol / L |
下列操作中不正确的是()
| A.过滤时,玻璃棒与三层滤纸的一边接触 |
| B.过滤时,漏斗下方紧贴烧杯内壁 |
| C.加热试管内物质时,试管底部与酒精灯灯芯接触 |
| D.向试管中滴加液体时,胶头滴管紧贴试管内壁 |
下列离子的检验方法中正确的是( )
A.某溶液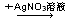 生成白色沉淀,说明原溶液中有Cl- 生成白色沉淀,说明原溶液中有Cl- |
B.某溶液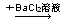 生成白色沉淀,说明原溶液中有SO42— 生成白色沉淀,说明原溶液中有SO42— |
C.某溶液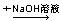 生成蓝色沉淀,说明原溶液中有Cu2+ 生成蓝色沉淀,说明原溶液中有Cu2+ |
D.某溶液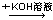 生成红褐色沉淀,说明原溶液中有Mg2+ 生成红褐色沉淀,说明原溶液中有Mg2+ |
为了除去硝酸钾晶体中所含的硫酸钙和硫酸镁,先将它配成溶液,然后先后加入KOH、K2CO3、Ba(NO3)2等试剂,配以过滤、蒸发结晶等操作,制成纯净的硝酸钾晶体,其加入试剂的顺序正确的是( )
| A.K2CO3——Ba(NO3)2——KOH——HNO3 |
| B.Ba(NO3)2——KOH——HNO3——K2CO3 |
| C.KOH——K2CO3——Ba(NO3)2——HNO3 |
| D.Ba(NO3)2——KOH——K2CO3——HNO3 |
下列事故或药品的处理正确的是()
| A.少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗 |
| B.将含硫酸的废液倒入水槽,用水冲入下水道 |
| C.制取并收集氧气结束后,应立即停止加热 |
| D.当出现CO中毒时,应立即将中毒者抬到室外新鲜空气处 |