下列实验中,所采取的分离方法与对应原理都正确的是
| 选项 |
目的 |
分离方法 |
原理 |
| A |
分离溶于水中的碘 |
乙醇萃取 |
碘在乙醇中的溶解度较大 |
| B |
分离乙酸乙酯和乙醇 |
分液 |
乙酸乙酯和乙醇的密度不同 |
| C |
除去KNO3固体中混杂的NaCl |
重结晶 |
NaCl在水中的溶解度很大 |
| D |
除去丁醇中的乙醚 |
蒸馏 |
丁醇与乙醚的沸点相差较大 |
科学家将 和
和 两原子经核聚合放出一定数目的中子,得到112号新元素,该元素原子的质量数为267。下列有关该元素的说法正确的是
两原子经核聚合放出一定数目的中子,得到112号新元素,该元素原子的质量数为267。下列有关该元素的说法正确的是
| A.位于第七周期第Ⅷ族 | B.具有“两性” |
| C.原子核外共有6个电子层 | D.该原子中,中子数与质子数之差为43 |
下列各组粒子中,所含化学键类型有差异的是
| A.CCl4和CH2Cl2 | B.H3O+和NH4+ |
| C.CaO2和CaF2 | D.Ba(0H)2和NaOH |
太阳能的开发和利用是21世纪一个重要课题。利用储能介质储存太阳能的原理是:白天在太阳照射下某种盐熔化,吸收热量,晚间熔盐固化释放出相应的能量,已知数据:
| 盐 |
熔点(℃) |
熔化吸热(kJ·mol-1) |
参考价格(元·t-1) |
| CaCl2·6H2O |
29.9 |
37.3 |
780~850 |
| Na2SO4·10H2O |
32.4 |
77.0 |
800~900 |
| Na2HPO4·12H2O |
35.1 |
100.1 |
1 600~2 000 |
| Na2S2O3·5H2O |
45.0 |
49.7 |
1 400~1 800 |
其中最适宜选用作为储能介质的是
A.CaCl2·6H2O B.Na2SO4·10H2O
C.Na2HPO4·12H2O D.Na2S2O3·5H2O
下列说法正确的是
| A.IA族元素的金属性比ⅡA族元素的金属性强 |
| B.P、S、Cl得电子能力和最高价氧化物对应水化物的酸性均依次增强 |
| C.同周期非金属氧化物对应的水化物的酸性从左到右依次增强 |
| D.第三周期元素的离子半径从左到右逐渐减小 |
某学生用下图所示装置进行化学反应X+2Y==2Z能量变化情况的研究。当往试管中滴加试剂Y时,看到U型管中液面甲处降、乙处升。关于该反应的下列叙述:
①该反应为放热反应;
②该反应为吸热反应;
③生成物的总能量比反应物的总能量更高;
④反应物的总能量比生成物的总能量更高;
⑤该反应过程可以看成是“贮存”于X、Y内部的部分能量转化为热量而释放出来。
其中正确的是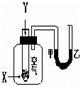
| A.①③ | B.①④⑤ | C.②③⑤ | D.①④ |