己知N2(g)+3H2(g)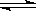 2NH3(g)△H=﹣92.4kJ•mo1﹣1,下列结论正确的是
2NH3(g)△H=﹣92.4kJ•mo1﹣1,下列结论正确的是
| A.在密闭容器中加入1mol N2和3mol H2充分反应放热92.4kJ |
B.N2(g)+3H2(g)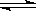 2NH3(l)△H=﹣QkJ•mo1﹣1,则Q>92.4 2NH3(l)△H=﹣QkJ•mo1﹣1,则Q>92.4 |
| C.增大压强,平衡向右移动,平衡常数增大 |
| D.若一定条件下反应达到平衡,N2的转化率为20%,则H2的转化率为60% |
下列说法中不正确的是()
| A.甲烷是最简单的有机化合物 | B.碳原子能形成四个共价键 |
| C.正丁烷和异丁烷互为同分异构体 | D.甲烷和氯气混合光照后,发生了加成反应 |
下列物质中只含有离子键的是()
| A.HI | B.NaOH | C.H2 | D.NaCl |
下列过程属于吸热反应的是()
| A.液态水汽化 | B.氢气燃烧 |
| C.浓硫酸的稀释 | D.Ba(OH)2·8H2O和NH4Cl(固体)混合 |
下列有关右图装置的叙述正确的是()
| A.铜是负极,铜片上有气泡产生 | B.铜片质量逐渐减少 |
| C.电流从锌片经导线流向铜片 | D.氢离子在铜片表面被还原 |
下列关于非金属元素C、N、Si、S、Cl的叙述正确的是()
A.在通常情况下它们的单质均为气体
B.每一种元素都只能形成一种单质
C.它们的最高价氧化物的水化物都属于酸
D.它们的氢化物的水溶液都显酸性