有3份等质量的小苏打,第1份直接与过量盐酸反应;第2份先加热,使其部分分解后,再与过量盐酸反应;第3份先加热,使其完全分解后,再与过量盐酸反应。假若盐酸的物质的量浓度相同,实际消耗盐酸的体积分别为V1、V2和V3,则V1、V2和V3的大小关系正确的是
| A.V1>V2>V3 | B.V1>V3>V2 | C.V2>V3>V1 | D.V1=V2=V3 |
下图所示的实验方法、装置或操作完全正确的是()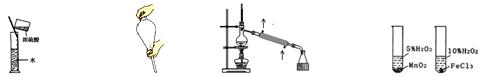
A.稀释浓H2SO4 B.萃取时振荡 C.石油的蒸馏
25℃时,水中存在电离平衡:H2O 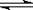 H++OH- ΔH>0。下列叙述正确的是()
H++OH- ΔH>0。下列叙述正确的是()
| A.将水加热,Kw增大,pH不变 |
| B.向水中加入少量NaHSO4固体,c(H+)增大,Kw不变 |
| C.向水中加入少量NaOH固体,平衡逆向移动,c(OH-)降低 |
| D.向水中加入少量NH4Cl固体,平衡正向移动,c(OH-)增大 |
实验室从海带中提取碘的操作过程中,仪器选用不正确的是()
MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如下图所示,下列叙述中正确的是
| A.MOH和ROH都是强碱 |
| B.在x点,c(M+)=c(R+) |
| C.稀释前,c(ROH)=10c(MOH) |
D.常温下,pH之和为14的 醋酸和ROH溶液等体积混合,所得溶液呈碱性 醋酸和ROH溶液等体积混合,所得溶液呈碱性 |
下列离子方程式正确的是
| A.次氯酸钙溶液中通入过量二氧化碳 Ca2++2ClO—+H2O+CO2=CaCO3↓+2HClO |
| B.常温时偏铝酸钠溶液pH>7 AlO2—+2H2O=Al(OH)3↓+OH— |
| C.等物质的量浓度的FeI2溶液与溴水等体积混合 2Fe2++2I—+2Br2=2Fe3++I2+4Br— |
| D.向硫酸氢钠溶液中滴加Ba(OH)2溶液恰好至中性 2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |