一般情况下,前者无法决定后者的是
| A.原子核外电子排布——元素在周期表中的位置 |
| B.弱电解质的相对强弱——电离常数的大小 |
| C.分子间作用力的大小——分子稳定性的高低 |
| D.物质内部储存的能量高低——化学反应的热效应 |
分析下表中的四个热化学方程式,判断氢气和丙烷的燃烧热分别是
| “嫦娥一号”发射火箭燃料 |
液氢(H2) |
①2H2(g)+O2(g) 2H2O(l) ΔH="-571.6" kJ·mol-1 2H2O(l) ΔH="-571.6" kJ·mol-1②2H2 (l)+O2(l)  2H2O(g) ΔH="-482.6" kJ·mol-1 2H2O(g) ΔH="-482.6" kJ·mol-1 |
| 北京奥运“祥云”火炬燃料 |
丙烷 (C3H8) |
③C3H8 (l)+5O2(g) 3CO2(g)+4H2O(g) ΔH="-2" 013.8 kJ·mol-1 3CO2(g)+4H2O(g) ΔH="-2" 013.8 kJ·mol-1④C3H8(g)+5O2(g)  3CO2(g)+4H2O(l) ΔH="-2" 221.5 kJ·mol-1 3CO2(g)+4H2O(l) ΔH="-2" 221.5 kJ·mol-1 |
A.571.6 kJ·mol-1,2 221.5 kJ·mol-1
B.241.3 kJ·mol-1,2 013.8 kJ·mol-1
C.285.8 kJ·mol-1,2 013.8 kJ·mol-1
D.285.8 kJ·mol-1,2 221.5 kJ·mol-1
下列事实中,不能用勒夏特列原理解释的是
| A.对熟石灰的悬浊液加热,悬浊液中固体质量增加 |
| B.实验室中常用排饱和食盐水的方式收集氯气 |
| C.打开汽水瓶,有气泡从溶液中冒出 |
| D.向稀盐酸中加入少量蒸馏水,盐酸中氢离子浓度降低 |
强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)=H2O(1)△H=-57.3kJ/mol。向1L0.5mol/L的NaOH溶液中加入下列物质:①稀醋酸②浓硫酸③稀硝酸,恰好完全反应时的热效应△H1、△H2、△H3的关系正确的是
| A.△H1>△H2>△H3 | B.△H1<△H3<△H2 |
| C.△H1<△H2<△H3 | D.△H1>△H3>△H2 |
一定条件下,可逆反应N2 +3H2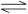 2NH3(正反应为放热反应)达到平衡,当单独改变下述条件后,有关叙述错误的是
2NH3(正反应为放热反应)达到平衡,当单独改变下述条件后,有关叙述错误的是
| A.加催化剂,V正、V逆 都发生变化,且变化的倍数相等 |
| B.加压,V正、V逆 都增大,且V正 增大的倍数大于V逆 增大的倍数 |
| C.降温,V正、V逆 都减小,且V正 减小的倍数大于V逆 减小的倍数 |
| D.增大氮气的浓度,V正增大、V逆 不变,N2 转化率减小,H2转化率增大 |
在密闭容器中发生如下反应:mA(g)+nB(g) pC(g)达到平衡后,保持温度不变,将气体体积缩小到原来的1/2,当达到新平衡时,C的浓度为原来的1.9倍。下列说法中正确的是
pC(g)达到平衡后,保持温度不变,将气体体积缩小到原来的1/2,当达到新平衡时,C的浓度为原来的1.9倍。下列说法中正确的是
| A.m+n>p | B.平衡向逆反应方向移动 |
| C.A的转化率增大 | D.C的体积分数增加 |