有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Cu2+、Al3+、NO3-、CO32-、SO42-,现取三份100mL溶液进行如下实验:
①第一份加足量AgNO3溶液后,有白色沉淀产生。
②第二份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99 g。
③第三份逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图。
根据上述实验,以下推测不正确的是
| A.原溶液一定不存在H+、Cu2+、CO32- |
| B.不能确定原溶液是否含有K+、NO3- |
| C.实验所加的NaOH的浓度为2mol·L-1 |
| D.原溶液确定含Mg2+、Al3+、NH4+,且n(Mg2+):n(Al3+):n( NH4+)=1:1:2 |
木糖醇是一种新型的甜味剂,它具有甜味足,溶解性好,防龋齿,适合糖尿病患者的食用。它是一种白色粉末状的结晶,结构简式为: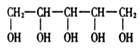
下列有关木糖醇的叙述中正确的是()
| A.木糖醇是—种单糖,不能发生水解反应 |
| B.木糖醇在一定条件下能发生消去反应 |
| C.木糖醇难溶于水,能发生酯化反应 |
| D.1mol木糖醇与足量钠反应最多可产生5molH2 |
在实验室里不宜长期放置,应在使用时配制的是( )
①酚酞试剂②银氨溶液③Na2CO3溶液
④氢氧化铜悬浊液⑤酸化的FeCl3溶液⑥硫化氢水溶液
| A.只有②④ | B.除①之外 | C.只有②④⑥ | D.全部 |
为检验某卤代烃(R—X)中的X元素,有下列实验操作,操作先后顺序正确的是( )
①加热煮沸②加入AgNO3溶液③取少量卤代烃
④加入稀硝酸酸化⑤加入NaOH溶液⑥冷却
| A.③①⑤⑥②④ | B.③②①⑥④⑤ | C.③⑤①⑥④② | D.③⑤①⑥②④ |
为提纯下列物质(括号内为少量杂质),有关除杂试剂和分离方法的选择正确的是( )
| 选项 |
被提纯物质 |
除杂试剂 |
分离方法 |
| A |
己烷(己烯) |
溴水 |
分液 |
| B |
乙酸乙酯(乙酸) |
乙醇 |
蒸馏 |
| C |
BaSO4(Na2SO4) |
水 |
过滤 |
| D |
NaHCO3(Na2CO3) |
盐酸 |
— |
三氯生的化学名为2,4,4-三氯-2-羟基二苯醚,被广泛应用于肥皂、牙膏等日用化学品之中,有杀菌消毒等作用。则下列有关说法中不正确的是()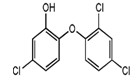
| A.物质的分子式为C12H6Cl3O2 |
| B.该物质与浓溴水可发生取代反应 |
| C.该物质中所有原子不一定在同一平面上 |
| D.该物质苯环上的一溴取代物有6种 |