氨气分了空间构型是三角锥形,而甲烷是正四而体形,这是因为
| A.两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化 |
| B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道 |
| C.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强 |
| D.氨气的相对分子质量大于甲烷 |
最近,科学家在甲烷的低温活化与二氧化碳加氢研究上取得了突破,其反应原理如下: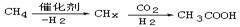 。下列说法错误的是
。下列说法错误的是
| A.CO2、CH3COOH均为共价化合物 |
| B.每生成1molCH3COOH,要消耗22.4LCO2 |
| C.CO2、CH3COOH分子中均含σ键和π键 |
D.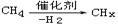 属于氧化反应 属于氧化反应 |
对实验甲、乙、丙、丁的叙述不正确的是
| A.实验甲:逐滴滴加盐酸时,开始无明显现象,然后才有大量气泡产生 |
| B.实验乙:充分振荡后静置,下层溶液为橙红色,上层无色 |
| C.实验丙:可测定胆矾晶体中结晶水的质量分数 |
| D.实验丁:酸性KMnO4溶液中有气泡出现,且溶液颜色会逐渐变浅至褪去 |
对于可逆反应A(g) + 2B(g) 2C(g) ΔH>0,下列图象正确的是
2C(g) ΔH>0,下列图象正确的是
一定温度下,在体积为10L的密闭容器中充满NH3,进行如下反应:
2NH3(g) 3H2(g)+N2(g);经5s达到平衡,平衡时NH3和H2的浓度均为bmol/L。下列叙述中不正确的是
3H2(g)+N2(g);经5s达到平衡,平衡时NH3和H2的浓度均为bmol/L。下列叙述中不正确的是
A.NH3在5s内的平均速度为 mol/(L·s) mol/(L·s) |
| B.达到平衡时NH3的分解率为40% |
C.N2的平衡浓度为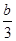 mol/L mol/L |
| D.反应开始时与平衡时的压强比为5∶7 |
下列各组热化学方程式中,化学反应的ΔH前者大于后者的是
①C(s)+O2(g)===CO2(g)ΔH1 C(s)+ O2(g)===CO(g)ΔH2
O2(g)===CO(g)ΔH2
②S(s)+O2(g)===SO2(g) ΔH3 S(g)+O2(g)===SO2(g) ΔH4
③H2(g)+ O2(g)===H2O(l)ΔH5 2H2(g)+O2(g)===2H2O(l)ΔH6
O2(g)===H2O(l)ΔH5 2H2(g)+O2(g)===2H2O(l)ΔH6
④CaCO3(s)===CaO(s)+CO2(g) ΔH7 CaO(s)+H2O(l)===Ca(OH)2(s) ΔH8
| A.①② | B.②③ | C.②③④ | D.①②③ |