从海水中制得的氯化钠除食用外,还可用作工业原料,生成多种含钠或氯的化工产品,利用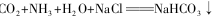 +NH4Cl的反应原理可制备纯碱,下面是在实验室进行模拟实验的生产流程示意图。
+NH4Cl的反应原理可制备纯碱,下面是在实验室进行模拟实验的生产流程示意图。
饱和食盐水溶液
则相关的说法错误的是
| A.通入的气体:A是CO2,B是NH3 |
| B.NaHCO3溶解度比NaCl、Na2CO3、NH4HCO3和NH4Cl的溶解度都小 |
| C.步骤(3)的操作为过滤,滤液可作化学肥料 |
| D.步骤(4)中,将晶体加热分解可以得到纯碱 |
聚甲基丙烯酸甲酯的单体与氢氧化钠共热后的体系中,当加入盐酸后能得到两种有机物,下列的哪一种物质与产物之一互为同系物
| A.丁酸 | B.丙烯酸 | C.甲酸丙酯 | D.甲酸丙烯酯 |
维生素C的结构简式为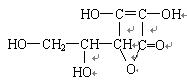 ,有关它的叙述错误的是
,有关它的叙述错误的是
| A.是一个环状的酯类化合物 | B.易起氧化及加成反应 |
| C.容易溶解于乙醇 | D.在碱性溶液中能稳定地存在 |
甲基丙烯酸甲酯是世界上年产量超过100万吨的高分子单体,旧法合成的反应是:
(CH3)2 C=O+HCN—→(CH3)2 C(OH)CN
(CH3)2C(OH)CN+CH3OH+H2SO4—→CH2=C(CH3)COOCH3+NH4HSO4
90年代新法的反应是: CH3C≡CH + CO + CH3OH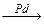 CH2=C(CH3)COOCH3
CH2=C(CH3)COOCH3
与旧法比较,新法的优点是
| A.原料无爆炸危险 | B.原料都是无毒物质 |
| C.没有副产物,原料利用率高 | D.产品性能更好 |
“不粘锅”的内层其实是在金属的内壁涂了一层聚四氟乙烯,故而不粘食物。以下对聚四氟乙烯的叙述错误的是:
| A.它是通过加聚反应得到的 | B.其中的C-F键非常稳定 |
| C.它的单体含有C=C双键 | D.分子内支链多且互相缠绕 |
下列混合物的物质的量一定时,组内各物质按任意比混合,完全燃烧耗O2的量不变的是
| A.甲烷、甲醇、甲醛; | B.乙炔、苯、1,3-丁二烯 |
| C.丙烯、2-丁烯、环已烷 | D.乙醇、乙烯、丙烯酸(CH2=CH-COOH) |