将几滴KSCN(SCN是“类似卤离子”)溶液加入到酸性的含有Fe3+的溶液中,溶液变为红色,
将该红色溶液分为两份:①向其中一份中加入适量KMn04溶液,红色褪去;②向另一份中通入S02,红色也褪去。下列说法中不正确的是
| A.①中红色褪去的原因是KMn04将SCN-氧化,使Fe(SCN)3消失 |
| B.②中红色褪色的原因是S02将Fe3+还原为Fe2+ |
| C.②中红色褪色的原因是SO2将SCN还原 |
| D.SCN在适当条件下可失去电子被氧化剂氧化为(SCN)2 |
铋(Bi)位于元素周期表中ⅤA族,其价态为+3价较稳定,铋酸钠(NaBiO3)溶液呈无色,取一定量的硫酸锰(MnSO4)溶液依次滴加下列溶液,对应的现象如下表所示:
| 加入溶液 |
①适量铋酸钠溶液 |
②过量的双氧水 |
③适量KI淀粉溶液 |
| 实验现象 |
溶液呈紫红色 |
紫红色消失,产生气泡 |
溶液变成蓝色 |
关于NaBiO3、KMnO4、I2、H2O2的氧化性由强到弱的顺序为
A.I2、H2O2、KMnO4、NaBiO3B.H2O2、I2、NaBiO3、KMnO4
C.NaBiO3、KMnO4、H2O2、I2D.KMnO4、NaBiO3、I2、H2O2
下列热化学方程式或离子方程式中正确的是
A.溴乙烷与6mol/L的氢氧化钠水溶液共热:C2H5Br+OH-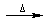 CH2=CH2↑+Br-+H2O CH2=CH2↑+Br-+H2O |
B.等物质的量浓度、等体积的Ca(HCO3)2溶液与氢氧化钠溶液相混合:Ca2++HCO3-+OH- CaCO3↓+H2O CaCO3↓+H2O |
C.在含有等物质的量的Fe(NO3)2和KI组成的混合溶液中滴入1-2滴盐酸:3Fe2++4H++NO3- 3Fe3++NO↑+2H2O 3Fe3++NO↑+2H2O |
D.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)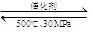 2NH3(g);△H=-38.6kJ·mol-1 2NH3(g);△H=-38.6kJ·mol-1 |
下列实验操作与预期实验目的或所得实验结论一致的是
| 选项 |
实验操作 |
实验目的或结论 |
| A |
某钾盐溶于盐酸,产生能使澄清石灰水变浑浊的无色无味气体 |
说明该钾盐是 |
| B |
向含有少量 的 的 溶液中加入足量 溶液中加入足量 粉末,搅拌一段时间后过滤 粉末,搅拌一段时间后过滤 |
除去 溶液中少量 溶液中少量 |
| C |
常温下,向饱和 溶液中加少量 溶液中加少量 粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生 粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生 |
说明常温下  |
| D |
 与浓硫酸170℃共热,制得的气体通入酸性 与浓硫酸170℃共热,制得的气体通入酸性 溶液 溶液 |
检验制得气体是否为乙烯 |
下列各选项所述的两个量,前者一定大于后者的是
①HF和HBr的沸点。②纯水在25℃和80℃时的PH。
③同温下分别在100g水中最多能溶解的无水CuSO4和CuSO4·5H2O的质量。
④25℃时,等体积的pH都等于3的盐酸和AlCl3溶液中,已电离的水的分子数。
⑤在NH3+NO→N2+H2O反应中,被氧化和被还原的N原子数。⑥O2-和Na+离子半径
| A.①③⑤ | B.①②⑥ | C.②③⑤ | D.②④⑥ |
“封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未画出),判断下列说法正确的是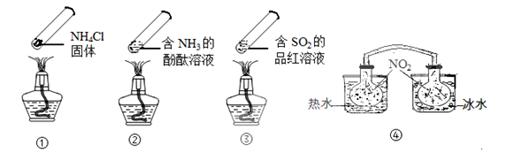
| A.加热时,①上部汇集了固体NH4Cl,说明NH4Cl的热稳定性比较好 |
| B.加热时,②、③溶液均变红,冷却后又都变为无色 |
| C.④中,浸泡在热水中的容器内气体颜色变深,浸泡在冰水中的容器内气体颜色变浅 |
| D.四个“封管实验”中所发生的化学反应都是可逆反应 |