向18.4 g铁和铜组成的合金中加入过量的硝酸溶液,合金完全溶解,同时生成NO2、NO混合气体,再向所得溶液中加入足量的NaOH溶液,生成30.3 g沉淀。另取等质量的合金,使其与一定量的Cl2恰好完全反应,则Cl2 的体积在标准状况下为
| A.7.84L | B.6.72L | C.4.48L | D.无法计算 |
相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g) 
 2NH3(g) ΔH=-92.6 kJ/mol。实验测得起始、平衡时的有关数据如下表所示:
2NH3(g) ΔH=-92.6 kJ/mol。实验测得起始、平衡时的有关数据如下表所示:
| 容器编号 |
起始时各物质的物质的量/mol |
达平衡时体系能量的变化 |
||
| N2 |
H2 |
NH3 |
||
| ① |
1 |
3 |
0 |
放出热量:23.15 kJ |
| ② |
0.9 |
2.7 |
0.2 |
放出热量:Q |
下列叙述错误的是 ( )
A.容器①、②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数均为1/7
C.容器②中达平衡时放出的热量Q=23.15 kJ
D.若容器①的体积为0.5 L,则平衡时放出的热量小于23.15 kJ
一定温度下,容积为2 L的甲、乙两固定容积的密闭容器中,发生反应:
2SO2(g)+O2(g) 2SO3(g)。达平衡时测得有关数据如下表。
2SO3(g)。达平衡时测得有关数据如下表。
| 容器 |
甲 |
乙 |
| 反应物投入量 |
2 mol SO2、1 mol O2 |
4 mol SO3 |
| n(SO3)/mol |
1.6 |
a |
| 反应物的转化率 |
α1 |
α2 |
下列说法正确的是
A.α1+α2>1
B.1.6<a<3.2
C.若甲中反应2 min时达到平衡,则2 min 内平均速率ν(O2)=" 0.1" mol·L-1·min-1
D.甲平衡后再加入0.2 mol SO2、0.2 mol O2和0.4 mol SO3,平衡正向移动
在一体积可变的密闭容器中,加入一定量的X、Y,发生反应mX(g) nY(g); ΔH=QkJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:
nY(g); ΔH=QkJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:
下列说法正确的是( )
| A.m>n |
| B.Q<0 |
| C.温度不变,压强增大,Y的质量分数减小 |
| D.体积不变,温度升高,平衡向逆反应方向移动 |
已知:2CO(g)+O2(g)===2CO2(g) ΔH=-566kJ·mol-1
Na2O2(s)+CO2(g)===Na2CO3(s)+1/2O2(g) ΔH=-226 kJ·mol-1
根据以上热化学方程式判断,下列说法正确的是( )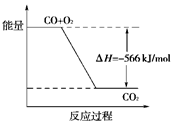
| A.CO的燃烧热为283kJ |
| B.上图可表示由CO生成CO2的反应过程和能量关系 |
| C.2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g)ΔH>-452 kJ·mol-1 |
| D.CO(g)与Na2O2(s)反应放出509kJ热量时,电子转移数为6.02×1023 |
下列热化学方程式正确的是(注:ΔH的绝对值均正确)( )
| A.C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(g) ΔH=-1 367.0 kJ·mol-1(燃烧热) |
| B.Ba(OH)2(aq)+2HCl(aq)===BaCl2(aq)+2H2O(l) ΔH=-57.3 kJ·mol-1(中和热) |
| C.S(s)+O2(g)===SO2(g) ΔH=-269.8 kJ·mol-1(反应热) |
| D.2NO2===O2+2NO ΔH=+116.2 kJ·mol-1(反应热) |