已知Fe3O4可表示成FeO·Fe2O3,水热法制备Fe3O4纳米颗粒的总反应为: 3Fe2++2S2O32-+O2+4OH-= Fe3O4+S4 O62-+2H2O。下列说法正确的是
| A.O2和S2O32-是氧化剂,Fe2+是还原剂 |
| B.每生成1 mol Fe3O4,转移电子的物质的量为2 mol |
| C.若有2 mol Fe2+被氧化,则被Fe2+还原的O2为0.5 mol |
| D.参加反应的氧化剂与还原剂的物质的量之比为1∶1 |
氧化还原反应与四种基本反应类型的关系如图所示。下列化学反应属于阴影部分的是
| A.4NH3 +5O2 =4NO+6 H2O |
| B.4Fe(OH)2+O2+2H2O=4Fe(OH)3 |
| C.2NaHCO3=Na2CO3+H2O+CO2↑ |
| D.Cl2+2NaBr=2NaCl +Br2 |
如图装置中,U形管内为红墨水,a、b试管内分别盛有食盐水和氯化铵溶液(呈酸性),各加入生铁块,放置一段时间。下列有关描述错误的是()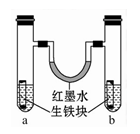
| A.生铁块中的碳是原电池的正极 |
| B.红墨水柱两边的液面变为左低右高 |
| C.两试管中相同的电极反应式是:Fe →Fe2++2e- |
| D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀 |
下列现象与电化学腐蚀无关的是()
| A.生铁比纯铁更易生锈 |
| B.黄铜(铜锌合金)制作的铜锣不易产生铜绿 |
| C.银质奖章久置后易表面变暗 |
| D.海轮上一般会在吃水线下绑定一定量的锌块 |
在25℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,下列热化学方程式正确的是()
A.CH3OH(l)+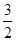 O2(g)=CO2(g)+2H2O(l);ΔH="+725.8" kJ/mol O2(g)=CO2(g)+2H2O(l);ΔH="+725.8" kJ/mol |
| B.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l);ΔH=-1452 kJ/mol |
| C.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l);ΔH=-725.8 kJ/mol |
| D.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l);ΔH="+1452" kJ/mol |
下列关于化学反应与能量的说法正确的是
| A.铵盐与碱的反应一般为放热反应 |
| B.化学反应一定既伴随着物质变化又伴随着能量变化 |
| C.反应物断旧键所吸收的能量高于生成物形成新键所放出的能量的反应为放热反应 |
| D.反应物所具有的总能量高于生成物所具有的总能量的反应为吸热反应 |