火力发电厂释放出大量氮氧化合物(NOx)、SO2和CO2等气体会造成环境问题。对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。
(1)脱硝。利用甲烷催化还原NOx:
CH4(g)+ 4NO2(g)=4NO(g)+ CO2(g)+ 2H2O(g) △H1=-574 kJ/mol
CH4(g)+ 4NO(g)=2N2(g)+ CO2(g)+ 2H2O(g) △H2=-1160 kJ/mol
甲烷直接将NO2还原为N2的热化学方程式为 。
(2)脱碳。将CO2转化为甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3
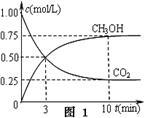
①在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2进行上述反应。测得CO2和CH3OH(g)浓度随时间变化如图1所示。回答:0~10 min内,氢气的平均反应速率为 mol/(L·min);第10 min后,保持温度不变,向该密闭容器中再充入1 mol CO2(g)和1 mol H2O(g),则平衡 (填“正向”、“逆向”或“不”)移动。
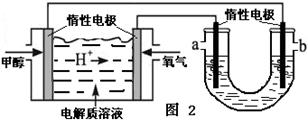
②如图2,25℃时以甲醇燃料电池(电解质溶液为稀硫酸)为电源来电解300mL 某NaCl溶液,正极反应式为 。在电解一段时间后,NaCl溶液的pH值变为13(假设NaCl溶液的体积不变),则理论上消耗甲醇的物质的量为 mol。
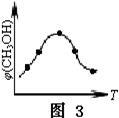
③取五份等体积的CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图3所示,则上述CO2转化为甲醇的反应的△H3 0(填“>”、“<”或“=”)。
(3)脱硫。燃煤废气经脱硝、脱碳后,与一定量氨气、空气反应,生成硫酸铵。硫酸铵水溶液呈酸性的原因是 (用离子方程式表示);室温时,向(NH4)2SO4,溶液中滴人NaOH溶液至溶液呈中性,则所得溶液中微粒浓度大小关系c(Na+) c(NH3·H2O)。(填“>”、“<”或“=”)
某实验小组用下列装置进行乙醇催化氧化的实验.
(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学反应方程式:
________________________________________________________________________
________________________________________________________________________.
在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇的氧化反应是________反应.
(2)甲和乙两个水浴作用不相同.
甲的作用是________;乙的作用是________.
(3)反应进行一段时间后,干燥试管a中能收集到不同的物质,它们是________.集气瓶中收集到的气体的主要成分是________.
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有________.要除去该物质,可先在混合液中加入________(填写字母).
a.氯化钠溶液 b.苯
c.碳酸氢钠溶液 d.四氯化碳
然后,再通过________(填实验操作名称)即可除去.
由丁炔二醇可以制备l,3丁二烯.请根据下面的合成路线图填空:
(1)写出各反应的反应条件及试剂名称:
X____________;Y______________;Z____________.
(2)写出A、B的结构简式:
A________________;B________________.
已知戊醇(C5H12O)共有8种属于醇的同分异构体,请回答:
(1)戊醇的这8种同分异构体中能氧化成醛的有4种,它们是:CH3(CH2)3CH2OH和(写结构简式)____________________________________________________________________
________________________________________________________________________.
(2)戊醇的这8种同分异构体脱水后可得________种烯烃.
化合物甲、乙、丙有如下转化关系:
甲(C4H10O) (C4H8)
(C4H8) (C4H8Br2)
(C4H8Br2)
回答:
(1)甲中官能团的名称是________,甲属________类物质,甲可能的结构有________种,其中可催化氧化为醛的有________种.
(2)反应条件①为__________________________________________________,
条件②为__________________________________________________________.
(3)甲→乙的反应类型为________,乙→丙的反应类型为________.
(4)丙的结构简式不可能是________.
| A.CH3CH2CHBrCH2Br |
| B.CH3CH(CH2Br)2 |
| C.CH3CHBrCHBrCH3 |
| D.(CH3)2CBrCH2Br |
根据下面的反应路线及所给信息填空.
(1)A的结构简式是____________,名称是________.
(2)①的反应类型是______________;②的反应类型是______________.
(3)反应④的化学方程式是____________________________________________.