向密闭容器中充入物质的量浓度均为 0.1 mol/L的CH4 和 CO2,在一定条件下发生反应CH4(g)+CO2(g) 2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图所示。下列说法不正确的是
2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图所示。下列说法不正确的是
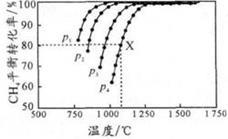
| A.平衡时CO与H2的物质的量比为1:1 |
| B.p1、p2、p3、p4由大到小的顺序为p1<p2<p3<p4 |
| C.1100℃,p4条件下,该反应10 min时达到平衡点X,则ν(CO2) = 0.008 mol•L-1•min-1 |
| D.随着温度升高,该反应的平衡常数减小 |
同温同压下,某容器充满N2重114 g,若充满He重102 g,现充满某气体重116 g,则某气体的相对分子质量为
| A.101 | B.17 | C.32 | D.10 |
a g CO2中含有b个分子,则阿伏加德罗常数为
| A.ab/44 mol-1 | B.44b /a | C.44b /a mol-1 | D.22b /a |
为了除去粗盐中的Ca2+,Mg2+,SO42-及泥沙,得到纯净的NaCl,可将粗盐溶于水,然后在下列操作中选取必要的步骤和正确的操作顺序:①过滤;②加过量NaOH溶液;③加适量盐酸;④加过量Na2CO3溶液;⑤加过量BaCl2溶液。
| A.④②⑤①③ | B.④②⑤③① | C.②⑤④①③ | D.①④②⑤③ |
下列叙述正确的是
| A.H2O2的相对分子质量为34g |
| B.1 mol SO42-的质量为96g |
| C.C2H4的摩尔质量与6.02×1023CO个分子的质量之和相等 |
| D.CH4的摩尔质量为16 g |
下列实验操作不正确的是
| A.分液时,上层液体上口出,下层液体下口出 |
| B.蒸馏烧瓶内液体的体积不超过其容积的2/3就可以 |
| C.当蒸发到剩有少量液体时,停止加热,利用余热将液体蒸干 |
| D.过滤时,不能用玻璃棒搅拌漏斗内的待过滤的液体 |