某硫酸厂废气中SO2的回收利用方案如图所示.下列说法错误的是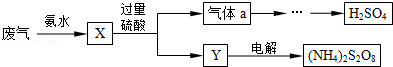
| A.X可能含有2种盐 |
| B.Y可能含有NH4HSO4 |
| C.a是SO3 |
| D.(NH4)2 S2O8中S的化合价不可能为+7 |
青海昆仑玉被定为2008年北京奥运会奖牌用玉,昆仑玉主要成分是由“透闪石”和“阳起石”组成的纤维状微晶结合体,透闪石(Tremolite)的化学成分为Ca2 Mg5Si8O22(OH)2.下列有关说法不正确的是
Mg5Si8O22(OH)2.下列有关说法不正确的是
| A.透闪石的化学式写成氧化物的形式为:2CaO·5MgO·8SiO2·H2O |
| B.透闪石中Mg元素的质量分数是Ca元素质量分数的1.5倍 |
| C.1 mol Ca2Mg5Si8O22(OH)2与足量的盐酸作用,至少需要14 mol HCl |
| D.透闪石是一种新型无机非金属材料,难溶于水 |
下列物质:①氢氟酸;②浓H2SO4;③烧碱溶液;④Na2CO3固体;⑤氧化钙;⑥浓HNO3,其中在一定条件下能与SiO2反应的有
| A.①②⑥ | B.全部 | C.①③④⑤ | D.②③⑥ |
实验是研究化学的基础,下图中所示的实验方法、装置或操作完全正确的是
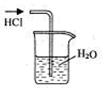
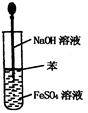
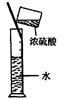
| A.干燥Cl2 | B.吸收HCl | C.制取Fe(OH)2沉淀 | D.稀释浓H2SO4 |
下列有关铁元素的叙述中正确的是
| A.铁是较活泼的金属,它与卤素(X2)反应的生成物均为FeX3 |
| B.氢氧化铁可以由相应的物质通过化合反应而制得 |
| C.氢氧化铁与氢碘酸反应:Fe(OH)3+3HI===FeI3+3H2O |
| D.铁元素位于周期表中第4周期ⅧB族 |
“5.12汶川大地震”后,消毒尤为重要,其中常用的消毒剂为“84”消毒液,其商品标识上有如下叙述:①本品为无色溶液,呈碱性②使用时加水稀释③可对餐具、衣物 进行消毒,可漂白浅色衣服。则其有效成份可能是
进行消毒,可漂白浅色衣服。则其有效成份可能是
| A.Cl2 | B.SO2 | C.NaClO | D.KMnO4 |