设NA为阿伏加德罗常数的数值,下列说法正确的是
| A.标准状况下,11.2 L水中含有分子的数目为0.5NA |
| B.1 mol Cl2与足量的NaOH溶液反应,转移的电子数为1NA |
| C.100 mL 0.2 mol·L-1的FeCl3溶液中,含Fe3+数为0.02NA |
| D.常温常压下,22.4 L的NO2和CO2混合气体含有2NA个O原子 |
一定浓度l00mL的HNO3溶液中加入2.8gFe,全部溶解,得到标准状况下的NO气体1.12L,测得反应后溶液中的c(H+)=0.1mol/L。若反应前后溶液体积变化忽略不计,则下列有关判断错误的是
| A.反应后溶液中无硝酸亚铁 |
B.反应前HNO3溶液的浓度为2.0mol |
C.反应后溶液中c(NO3-)=1.6mol |
| D.反应后的溶液最多还能溶解1.6lgFe |
某CuSO4、Fe2(SO4)3、H2SO4的混合溶液100 mL,已知溶液中各阳离子的浓度相同(不考虑溶液中离子的变化),且SO42-的物质的量浓度为6mol ,则此溶液最多能溶解铁粉的质量为
,则此溶液最多能溶解铁粉的质量为
| A.5.6g | B.11.2 g | C.22.4g | D.33.6g |
已知常温下氯酸钾与浓盐酸反应能放出氯气,现按右下图进行氯气的性质实验。玻璃管内分别装有滴有少量不同溶液的白色棉球,反应—段时间后,对图中指定部位颜色描述正确的是
在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液生成沉淀的量与滴入NaOH溶液的体积关系如图所示则原混合溶液中Al2(S04)3与MgSO4的物质的量浓度之比为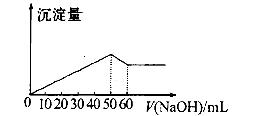
| A.6:1 | B.3:1 | C.2:1 | D.1:2 |
下列实验操作或方法中,正确的是