一定条件下,在体积为1 L的密闭容器中,1 mol X和1 mol Y进行反应:2X(g) +Y(g) Z(g),下列叙述能证明该反应已达到化学平衡状态的是
Z(g),下列叙述能证明该反应已达到化学平衡状态的是
| A.X的百分含量不再发生变化 |
| B.c(X):c(Y):c(Z)=2:1:1 |
| C.容器内原子总数不再发生变化 |
| D.同一时间内消耗2n mol X的同时生成n mol Z |
中学化学中很多“规律”都有其使用范围,下列根据有关“规律”推出的结论合理的是
| A.根据同周期元素的第一电离能变化趋势,推出Al的第一电离能比Mg大 |
| B.根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7 |
| C.根据溶液的pH与溶液酸碱性的关系,推出pH=6.8的溶液一定显酸性 |
| D.根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO |
用价层电子对互斥理论预测H2S和BF3的立体结构,两个结论都正确的是
| A.直线形;三角锥形 | B.V形;三角锥形 |
| C.直线形;平面三角形 | D.V形;平面三角形 |
图甲和图乙表示的是元素的某种性质随原子序数的变化。下列说法正确的是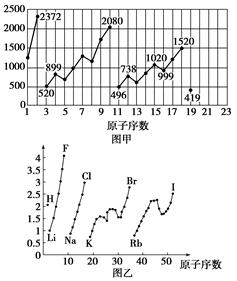
| A.图甲可能表示的是元素原子的第一电离能随原子序数的变化关系 |
| B.图甲可能表示的是元素单质的熔点随原子序数的变化关系 |
| C.图乙可能表示的是元素原子的半径随原子序数的变化关系 |
| D.图乙不可能表示同族元素的电负性随原子序数的变化关系 |
下列轨道表示式能表示氮原子的最低能量状态的是
A. |
B. |
C.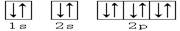 |
D. |
已知某+2价离子的电子排布式为1s22s22p63s23p63d9,该元素在周期表中所属的族是
| A.IIA | B.IB | C.IIB | D.VIII |