按下图装置,持续通入X气体,可以看到a处有红色物质生成,b处变蓝,c处得到液体,则X气体是
| A.H2 | B.CO和H2 | C.NH3 | D.CH3CH2OH(气) |
下列图示与对应的叙述一定正确的是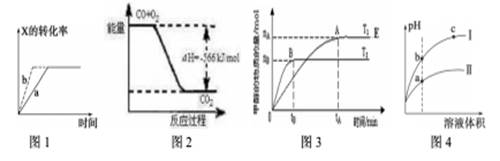
| A.图1所示,反应X(g)+2Y(g)3Z(g),b的压强一定比a大 |
| B.图2表示CO生成CO2的反应过程和能量关系 |
| C.图3表示反应CO+2H2CH3OH,其中温度T1>T2,在其他条件不变的情况下,将处于E点的体系的体积压缩到原来的1/2,平衡正向移动,氢气浓度增大 |
| D.图4所示,用水稀释pH相同的盐酸和醋酸,I表示盐酸,II表示醋酸,且溶液导电性c>b>a |
常温下a mol·L-1稀氨水和b mol·L-1稀盐酸等体积混合,对混合后溶液判断一定正确的是
| A.若a=b,则c(NH)=c(Cl-) |
| B.若a>b,则c(NH)>c(Cl-) |
| C.若a>b,则c(OH-)>c(H+) |
| D.若a<b,则c(OH-)<c(H+) |
I2在KI溶液中存在平衡:I2(aq)+I-(aq) I3-(aq),某I2、、KI混合溶液中, c(I3-)与温度T的平衡曲线图如下。下列说法不正确的是
I3-(aq),某I2、、KI混合溶液中, c(I3-)与温度T的平衡曲线图如下。下列说法不正确的是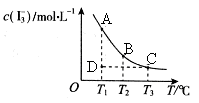
| A.反应I2(aq)+I-(aq)I3- (aq)的△H>0 |
| B.若温度为,反应的平衡常数分别为 |
| C.若反应进行到状态D时,一定有 |
| D.状态A与状态B相比,状态A的c(I2) 小 |
氯碱工业的产物NaOH与不同物质反应可以生成不同的盐。已知常温下,浓度均为0.1 mol/L的4种钠盐溶液pH如下表:
| 溶质 |
Na2CO3 |
NaHCO3 |
NaClO |
NaHSO3 |
| pH |
11.6 |
9.7 |
10.3 |
5.2 |
下列说法中正确的是
A.向氯水中加入NaHCO3,可以增大氯水中次氯酸的浓度
B.四种溶液中,水的电离程度最大的是NaClO
C.常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,pH最大的是H2SO3
D.NaHSO3溶液中离子浓度大小顺序为c(Na+)> c(H+)>c(HSO3-) >c(SO32-)>c(OH-)
相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:
X2(g) + 3Y2(g) 2XY3(g)△H="-92.6" kJ.mol-1
2XY3(g)△H="-92.6" kJ.mol-1
实验测得反应在起始、达到平衡时的有关数据如下表所示:
| 容器 编号 |
起始时各物质物质的量/mol |
达到平衡的时间 |
达平衡时体系能量的变化 |
||
| X2 |
Y2 |
XY3 |
|||
| ① |
1 |
3 |
0 |
2分钟 |
放热46.3kJ |
| ② |
0.4 |
1.2 |
1.2 |
/ |
Q(Q>0) |
下列叙述不正确的是
A.容器①中反应从开始到刚达平衡时用XY3表示的反应速率为v(XY3)="1/30" moI.L-l·s-1
B.平衡时,两个容器中XY3的物质的量浓度相等
C.容器②中反应达到平衡时吸收的热量为Q
D.容器①体积为0.3L,则达平衡时放出的热量大于46.3kJ