W、X、Y、Z是短周期元素,其部分性质如下表:
| W |
单质是淡黄色固体 |
| X |
在地壳中的含量居第二位 |
| Y |
原子最外层电子数是电子总数的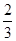 |
| Z |
第3周期原子半径最小的金属 |
下列说法正确的是
A.气态氢化物的热稳定性:X>W
B.非金属性:Y < W;离子半径:Z > W
C.W在空气中燃烧所得产物,可用于杀菌消毒
D.金属Z与少量NaOH溶液反应,生成两性氢氧化物
下列叙述中不属于土壤酸化原因的是( )。
| A.土壤胶体吸附的H+、Al3+被其他阳离子交换 |
| B.微生物、细菌在利用土壤中的有机物时,会产生二氧化碳和多种有机酸 |
| C.微生物、细菌在利用土壤中物质时,将土壤中的NH3转化为亚硝酸和硝酸,将硫化物转化为硫酸 |
| D.土壤有机物中的氮被微生物分解生成氨的氨化过程,会使土壤的pH升高 |
高效肥料一般是指含营养成分在30%以上的化肥。下列不属于高效肥料的是( )。
| A.尿素 | B.硝酸铵 | C.液氨 | D.氯化铵 |
要经常向农田里施用钾肥的主要原因是( )。
| A.土壤中钾元素的含量太少,需靠施用钾肥才能满足农作物生长的需要 |
| B.土壤中钾元素的含量不少,但大多数以难溶于水的矿物质形式存在,农作物难以吸收 |
| C.土壤中钾元素的含量不少,但都易溶于水被雨淋失,需施钾肥加以补充 |
| D.钾元素是农作物生长需要量最大的元素,必须经常施钾肥加以补充 |
某硝酸铵样品中混有另一种氮肥,经测定该样品中含氮38%,则该样品中可能混有的氮肥是( )。
| A.NH4HCO3 | B.(NH4)2SO4 | C.NH4Cl | D.CO(NH2)2 |
草木灰中含有碳酸钾,它属于( )。
| A.氮肥 | B.钾肥 | C.复合肥料 | D.微量元素肥料 |