氢能源是一种重要的清洁能源。现有两种可产生H2的化合物甲和乙。将6.00 g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72 L H2(已折算成标准状况)。甲与水反应也能产生H2,同时还产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液。化合物乙在催化剂存在下可分解得到H2和另一种单质气体丙,丙在标准状态下的密度为1.25 g/L。请回答下列问题:
(1)甲的化学式是_________;乙的电子式是__________。
(2)甲与水反应的化学方程式是______________。
(3)气体丙与金属镁反应的产物是_______(用化学式表示)。
(4)乙在加热条件下与CuO反应可生成Cu和气体丙,写出该反应的化学方程式 。
(5)甲与乙之间可能发生反应产生H2,理由是____________。
(1)用Al2(SO4)3制取Al(OH)3,常用氨水与Al2(SO4)3反应,而不用NaOH(aq),是什么原因? ________________________________________________________________。
(2)AlCl3与NaOH溶液反应,当Al3+与OH-的物质的量之比为________时沉淀最多,________时沉淀全部溶解,________时沉淀为最多时的一半。
(3)现代科学实验证明,溶液中不存在,应为[Al(OH)-4],是沿用旧的书写习惯。请写出Al2(SO4)3溶液与过量NaOH溶液反应的化学方程式(不能用偏铝酸盐表示):______________________。
有4种钠的化合物W、X、Y、Z,它们之间存在如下关系:
①W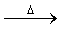 X+H2O+CO2↑
X+H2O+CO2↑
②Z+CO2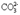 X+O2
X+O2
③Z+H2O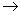 Y+O2↑
Y+O2↑
④X+Ca(OH)2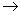 Y+CaCO3↓
Y+CaCO3↓
试回答下列问题:
(1)W、X、Y、Z的化学式分别是:W__________;X__________;Y__________;Z________。
(2)以上4个化学反应中,属于氧化还原反应的是________(填反应序号),反应中的氧化剂是________(写化学式),还原剂是________(写化学式)。
(3)若④反应在溶液中进行,写出其离子方程式以及能用该离子方程式表示的另一个化学反应的化学方程式:
①离子方程式:________________________________________________________;
②化学方程式:________________________________________________________。