以下数值大于或等于阿伏加德罗常数的是
| A.6g石墨中的共价键数目 |
| B.常温常压下,17g ND3中所含分子数目 |
| C.向0.2mol NH4Al(SO4)2溶液中滴加NaOH溶液至沉淀完全溶解,消耗的OH-数目 |
| D.0.1mol羟基(—OH)中所含电子数目 |
常温下,将0.2 mol·L-1的一元酸HA溶液和0.1 mol·L-1的NaOH溶液等体积混合后,pH大于7,若混合后溶液体积等于两溶液体积之和,则下列关系中正确的是
| A.[HA]<[A-] | B.[HA]一定大于0.1 mol·L-1 |
| C.[Na+]=[HA]+[A-] | D.2[OH-]=2[H+]+[HA]-[A-] |
下列实事能说明醋酸是弱电解质的是
①醋酸和水能以任意比互溶②醋酸溶液能导电 ③醋酸溶液中存在醋酸分子
④0.1mol·L-1的醋酸的pH比0.1mol·L-1的盐酸pH大 ⑤醋酸能和碳酸钙反应放出二氧化碳
⑥0.1mol·L-1的醋酸钠的pH=8.9 ⑦大小相同的锌粒与浓度相同的盐酸和醋酸反应醋酸产生H2的速率慢
| A.②⑥⑦ | B.③④⑥⑦ | C.③④⑤⑥ | D.①②③ |
有一粉末,它是由铁的氧化物物中的一种或两种组成,取3.04 g粉末加热,同时通入足量的CO使之完全反应,再用澄清石灰水把产生的气体充分吸收,产生沉淀5g,则该粉末的组成可能是
| A.只有Fe2O3 | B.只有FeO |
| C.等物质的量的FeO和Fe3O4 | D.等物质的量的Fe2O3和Fe3O4 |
某学生用NaHCO3和KHCO3组成的混合物样品与某种浓度的盐酸反应进行实验,测得数据如下表:
分析表中数据,下列说法中不正确的是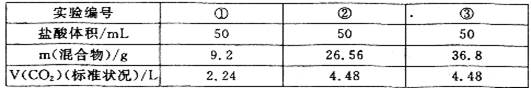
| A.由①、②可知:①中的盐酸过量 |
| B.由②、③可知:混合物的质量增加,而气体体积没有变化,说明盐酸已经反应完全 |
| C.所用盐酸的物质的量浓度为0.4 mol·L-1 |
| D.该混合物中NaHCO3的物质的量分数为50% |
将一定质量的Mg,Zn,Al混合物与足量稀H2SO4反应,生成H2 2.8L(标准状况),原混合物的质量可能是
| A.2g | B.4g | C.10g | D.12g |