下列说法正确的是
| A.ΔH<0、ΔS>0的反应在温度低时不能自发进行 |
| B.NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g)ΔH=+185.57 kJ·mol-1能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 |
| C.两种物质反应,无论方程式的书写形式如何,平衡常数均不变 |
| D.增大反应物浓度,使活化分子百分数增加,化学反应速率增大 |
下列有关化学用语表示正确的是()
A.对硝基甲苯的结构简式: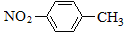
B氯化铵的电子式: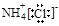
C.中子数为16的硫原子: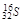
D.乙炔的最简式:CH
化学与人类生活、社会可持续发展密切相关。下列说法不正确的是()
| A.合理开发利用可燃冰(固态甲烷水合物)有助于缓解能源紧缺的状况 |
| B.大量使用化肥和农药,以提高农作物产量 |
| C.含磷化合物的排放是“水华”和“赤潮”产生的原因 |
| D.安装煤炭“固硫”装置,降低酸雨发生率 |
12.4 g Na2R含Na+0.4 mol,则Na2R的摩尔质量为,R的相对原子质量为.含R的质量为1.6 g的Na2R,其物质的量为.
下列说法中正确的是()
| A.NaCl溶液导电,所以NaCl溶液是电解质; |
| B.Cu能导电,所以Cu是电解质; |
| C.SO3溶于水能导电,所以SO3是电解质; |
| D.液态酒精、酒精的水溶液不导电,所以酒精是非电解质 |
对相同质量的SO2和SO3来说,下列关系正确的是( )
| A.含氧原子个数比为2∶3 | B.含氧元素质量比为5∶6 |
| C.含硫原子个数比为5:4 | D.含硫元素质量比为4∶5 |