合成氨反应为:N2(g)+3H2(g)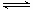 2NH3(g)。图1表示在一定的温度下此反应过程中的能量的变化,图2表示在2 L的密闭容器中反应时N2的物质的量随时间的变化曲线,图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。下列说法正确的是
2NH3(g)。图1表示在一定的温度下此反应过程中的能量的变化,图2表示在2 L的密闭容器中反应时N2的物质的量随时间的变化曲线,图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。下列说法正确的是

A.由图1可得加入适当的催化剂,E和ΔH都减小
B.图2中0~10 min内该反应的平均速率v(H2)=0.045 mol·L-1·min-1,从11 min起其他条件不变,压缩容器的体积为1 L,则n(N2)的变化曲线为d
C.图3中A、B、C三点所处的平衡状态中,反应物N2的转化率最高的是B点
D.图3中T1和T2表示温度,对应温度下的平衡常数为K1、K2,则:T1>T2,K1>K2
设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.1 mol/L氯化铜溶液中的Cu2+数小于NA |
| B.标准状况下,22.4 L Cl2参加任何化学反应转移的电子数都是2NA |
| C.28 g聚乙烯含有的碳原子数为2NA |
| D.1 mol CH5+所含电子数为8NA |
下列离子方程式书写正确的是
A.向海带灰浸出液中加入硫酸、双氧水:2I-+2H++H2O2 I2+2H2O I2+2H2O |
B.Cu片插入FeCl3溶液中:Cu+Fe3+ Fe2++Cu2+ Fe2++Cu2+ |
C.向Al2(SO4)3溶液中加入过量的氨水: Al3++4NH3·H2O  AlO2-+4NH4++2H2O AlO2-+4NH4++2H2O |
| D.向 NaHSO4溶液中滴加Ba(OH)2溶液至中性: |
H++SO42-+Ba2++OH- BaSO4↓+H2O
BaSO4↓+H2O
下列对某些问题的认识正确的是
| A.漂白粉和明矾都常用于自来水的处理,二者的作用原理是相同的 |
| B.SO32-、ClO-、NO3-三种酸根离子在溶液中能大量共存 |
| C.不能用带玻璃塞的玻璃瓶和酸式滴定管盛取碱液,二者的原因是相同的 |
| D.98%的浓硫酸用等体积的水稀释后,硫酸的质量分数为49% |
三硫化磷(P4S3)是黄绿色针状晶体,易燃、有毒,分子结构之一如下图所示,已知其燃烧热△H=-3677kJ/mol(P被氧化为P4O10),下列有关P4S3的说法中不正确的是
| A.分子中每个原子最外层均达到8电子稳定结构 |
| B.P4S3中硫元素为-2价磷元素为+3价 |
| C.热化学方程式为P4S3( s)+8O2(g)=P4O10(s )+3SO2(g)△H=-3677kJ/mol |
| D.一个P4S3分子中含有三个非极性共价键 |
关于下列各装置图的叙述中,正确的是
| A.若采用装置①精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液 |
| B.装置②是原电池,能将化学能转化为电能,锌电极发生还原反应 |
| C.装置③中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸 |
| D.装置④可用于收集氨气,并吸收多余的氨气 |