A(g)+B(g) 2C(g)反应在密闭容器中进行,若保持容积不变,在温度分别为T1和T2时,达到平衡,B的体积分数与时间的关系如图所示。现向一体积可变的密闭容器中通入等物质的量的A气体和B气体,在恒温条件下发生反应达到平衡状态Ⅰ后,再升高到某温度,继续反应一段时间后达到平衡状态Ⅱ。下列叙述中正确的是
2C(g)反应在密闭容器中进行,若保持容积不变,在温度分别为T1和T2时,达到平衡,B的体积分数与时间的关系如图所示。现向一体积可变的密闭容器中通入等物质的量的A气体和B气体,在恒温条件下发生反应达到平衡状态Ⅰ后,再升高到某温度,继续反应一段时间后达到平衡状态Ⅱ。下列叙述中正确的是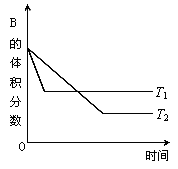
| A.T1>T2,该反应生成物的总能量高于反应物的总能量 |
| B.该反应在高温时才能自发进行 |
| C.由平衡状态Ⅰ到平衡状态Ⅱ的过程中,平衡向逆向移动,A的体积分数一直没有变化 |
| D.反应从开始到平衡状态Ⅱ的过程中,平衡常数K和A的转化率都是先增大后减少 |
足量的锌与酸反应,欲使制取氢气的反应速率尽可能大,选用的反应条件正确的组合是
①锌粒 ②锌粉 ③加少量的硫酸银的饱和溶液 ④1mol/L的盐酸 ⑤5mol/L的硝酸
⑥1mol/L的硫酸 ⑦加热 ⑧加大量的硫酸铜晶体 ⑨不断振荡 ⑩加大体系的压强
| A.②③⑥⑦⑨ | B.①③⑤⑦⑩ | C.②④⑥⑦⑧⑨ | D.②⑦⑧⑨⑩ |
现有常温时pH=1的某强酸溶液10mL,下列操作能使溶液的pH变成2的是
| A.加入10mL 0.01mol·L-1的NaOH溶液 |
| B.加入10mL 的水进行稀释 |
| C.加水稀释成100mL |
| D.加入10mL 0.01mol·L-1的盐酸溶液 |
下列反应常温时能自发进行,并既能用能量判据又能用熵判据解释的是
| A.HCl(g)+NH3(g)= NH4Cl(s) |
| B.2KClO3(s)=2KCl(s)+3O2(g) |
| C.2Na2O2(s)+2H2O(l)=4NaOH(s)+O2(g) |
| D.Ba(OH)2·8H2O(s)+2NH4Cl(s)=BaCl2(s)+ 2NH3(g)+10H2O(l) |
下图所示烧杯中均盛有海水,锌在其中被腐蚀的速率最慢的是
下列说法错误的是
| A.由单质A转化为单质B,ΔH=+119kJ/mol,可知单质A比单质B稳定 |
| B.灼热的碳与CO2反应既是氧化还原反应,又是生成物总能量高于反应物总能量的反应 |
| C.决定化学反应速率的根本因素是参加反应的各物质的结构和性质 |
| D.对于一个可逆反应(ΔH<0)达到平衡后,升高温度可以增加活化分子的百分数,提高有效碰撞的次数,使V正增大的倍数大于V逆增大的倍数,从而使化学反应平衡逆向移动 |