关于下列各装置图的叙述中,正确的是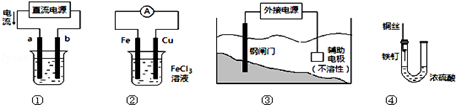
| A.用装置①精炼铜,则b极为粗铜,电解质溶液为CuSO4溶液 |
| B.装置②的总反应是:Cu+2Fe3+=Cu2++2Fe2+ |
| C.装置③中钢闸门应与外接电源的正极相连 |
| D.装置④中的铁钉几乎没被腐蚀 |
下列有关化学用语正确的是
A.Cl-离子的结构示意图: |
| B.玉的化学成分多为含水钙镁硅酸盐,如:Ca2Mg5Si8O22(OH)2可用氧化物表示为:2CaO·5MgO·8SiO2·H2O |
C.NaOH的电子式:Na [∶ ∶H ] ∶H ] |
D.丙烷分子的比例模型示意图: |
用NA表示阿伏加德罗常数的值。下列叙述正确的是
| A.常温常压下的33.6L氯气与27g铝充分反应,转移电子数为3NA |
| B.标准状况下,22.4L己烷中共价键数目为19NA |
| C.由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA |
| D.1L浓度为lmol·L-1的Na2CO3溶液中含有NA个CO32- |
下列反应不是氧化还原反应的是
| A.Fe+H2SO4(稀)=FeSO4+H2↑ | B.H2+CuO Cu+H2O Cu+H2O |
| C.3NO2+H2O=2HNO3+NO | D.Ca(HCO3) 2 CaCO3↓+H2O+CO2↑ CaCO3↓+H2O+CO2↑ |
下列物质中碱性最弱的是
| A.氢氧化钠 | B.氢氧化镁 | C.氢氧化铝 | D.氢氧化钙 |
已知:X2、Y2、Z2、W2四种物质的氧化能力W2>Z2>X2>Y2,下列氧化还原反应能发生的是()
| A.2NaW+Z2=2NaZ+W2 | B.2NaX+Z2=2NaZ+X2 |
| C.2NaY+W2=2NaW+Y2 | D.2NaZ+X2=2NaX+Z2 |