某稀溶液仅含Fe2+、Na+、Al3+、Ba2+、SO42-、NO3-、Cl-中的4种离子,所含离子的物质的量均为1mol。若向该溶液中加入适量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。下列说法正确的是
| A.若向该溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体的质量为72g |
| B.若向该溶液中加入过量的稀硫酸,溶液颜色会变成浅绿色 |
| C.若向该溶液中加入过量的稀硫酸和KSCN溶液,溶液不显血红色 |
| D.若向该溶液中加入过量的稀硫酸,产生的气体在标况下的体积约为7.467 L |
化学与能源开发、环境保护、资源利用等密切相关。下列说法正确的是
| A.天然气、石油、流水、风力、氢气为一级能源 |
| B.无论是风力发电还是火力发电,都是将化学能转化为电能 |
| C.PM 2.5含有的铅、镉、铬、钒、砷等对人体有害的元素均是金属元素 |
| D.发展低碳经济、循环经济,推广利用太阳能、风能的城市照明系统 |
一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为CH3CH2OH-4e-+H2O=CH3COOH+4H+。下列有关说法正确的是
| A.正极上发生的反应是:O2+4e-+2H2O=4OH- |
| B.该电池反应的化学方程式为:CH3CH2OH+3O2点燃2CO2+3H2O |
| C.检测时,电解质溶液中的H+向正极移动 |
| D.若有0.4mol电子转移,则在标准状况下消耗4.48L氧气 |
在体积一定的密闭容器中发生反应:2NH3(g) N2(g)+3H2(g),在673K、30MPa下,n(NH3)和n(N2)随时间变化的关系如图所示。下列叙述正确的是
N2(g)+3H2(g),在673K、30MPa下,n(NH3)和n(N2)随时间变化的关系如图所示。下列叙述正确的是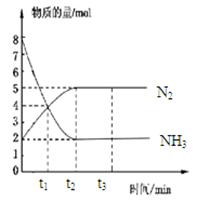
| A.t1时反应达到平衡 |
| B.t3时,v正(N2)﹥v逆(N2) |
| C.t2时和t3时n(H2)相等 |
| D.t3后,若体积不变充He,反应速率增大 |
下表是部分短周期元素的原子半径及主要化合价,根据表中信息,下列叙述正确的是
| 元素代号 |
L |
M |
Q |
R |
T |
| 原子半径/nm |
0.160 |
0.143 |
0.089 |
0.102 |
0.074 |
| 主要化合价 |
+2 |
+3 |
+2 |
+6、-2 |
-2 |
A.L2+与R2-的核外电子数相等
B.气态氢化物的热稳定性:H2T>H2R
C.M与T形成的化合物能溶于氨水溶液
D.相同条件下,单质与同浓度稀盐酸反应的速率:M>L
关于下列图示的说法正确的是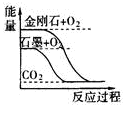

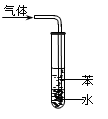
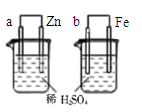

| A.图①表示石墨转变为金刚石是吸热反应 |
| B.图②所示实验可比较非金属性强弱:氯﹥碳﹥硅 |
| C.图③吸收NH3并防倒吸 |
| D.图④两装置中金属电极a、b都有气体产生,可判断金属活动性:a﹤b |