某学生设计了如图的方法对A盐进行鉴定: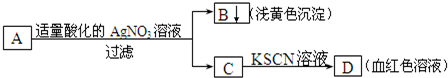
由此分析,下列结论中,正确的是
| A.A中一定有Fe2+ | B.B为AgI沉淀 |
| C.A中可能有Fe3+ | D.A一定为FeBr2溶液 |
下列关于环境、能源和材料的叙述中不正确的是()
| A.氮化硅、光导纤维均属于新型无机非金属材料 |
| B.日本福岛核电站泄漏的放射性核素131I与127I属于同素异形体 |
| C.在西部和沿海地区兴建风力发电站,可缓解能源短缺问题 |
| D.铁质器具表面刷漆或将其置于干燥处保存,均能有效减缓铁的锈蚀 |
化学与我们的生活息息相关,下列说法正确的是()
| A.红宝石、玛瑙、水晶、钻石的主要成分都是硅酸盐 |
| B.三大合成材料是指塑料、合成纤维和合成橡胶 |
| C.石油裂解、煤的汽化、海水蒸馏的过程中都发生了化学变化 |
| D.鸟巢使用了高强度、高性能的钒氮合金高新钢,铁合金熔点、硬度均比纯铁高 |
下列有关无机非金属材料的说法中,不正确的是()
| A.高纯硅可用于制造半导体材料 |
| B.SiO2制成的玻璃纤维,由于导电能力强而被用于制造光缆 |
| C.玻璃、水泥和陶瓷,其成分均含有硅酸盐 |
| D.Si3N4是一种新型无机非金属材料,可应用于制造发动机 |
下列有关物质的性质、应用的说法中正确的是()
| A.硅酸盐化学性质稳定,可用作光导纤维的材料 |
| B.K2FeO4具有还原性,可用于自来水的杀菌消毒 |
| C.液氨汽化吸收大量的热,可用作制冷剂 |
| D.HCl气体管道是否泄漏,可用蘸NaOH溶液的棉球进行检查 |
化学与生产、生活密切相关,下列有关说法正确的是()
| A.玻璃、陶瓷、水泥、光导纤维的化学组成都是硅酸盐 |
| B.青霉素素是一种广谱抗生素,在身体有炎症时可自行服用 |
| C.用于制作集成电路板的酚醛树脂是天然高分子化合物 |
| D.向淡水中加入NaCl等配成人造海水,可用于海产品的长途运输 |