氯水是实验室常需临时配制的一种试剂。图甲所示的是实验室配制氯水时的一种常用装置,图乙是某化学实验小组自行设计的一种配制氯水的装置(图中的鼓气球是一种具有气体单向阀的可用于向瓶中鼓入空气的仪器)。

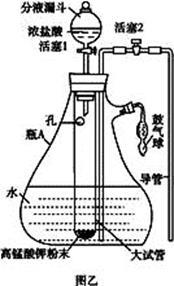
(1)氯水中含有七种粒子,其中的分子为 (化学式);
需临时配制的原因是 (用化学方程式表示)。
(2)图甲所示装置中,烧杯内的液体是 ,烧杯中发生反应的离子方程式是 。
(3)用图乙所示装置中配制氯水时,操作步骤如下:
①关闭活塞2 ,打开分液漏斗上口的玻璃塞,再打开活塞1 ,将少量浓盐酸注入大试管内。
②关闭活塞1 ,盖上分液漏斗上口玻璃塞。浓盐酸和大试管内的高锰酸钾粉末反应产生氯气。
③轻轻摇动瓶A ,使氯气不断溶入水中。
用图乙装置能在较短时间内得到饱和氯水。除了在摇动过程中增大了气体和水的接触面以外,另一个重要原因是 。
分液漏斗中的浓盐酸应分数次加入试管内。若一次加入太多的浓盐酸,可能引起的后果是 。
(4)配制氯水完成后,不必拆卸装置即可从瓶A 中取用少量氯水,方法是 。
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。请回答该实验中的问题。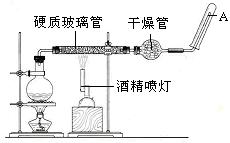
(1)写出该反应的化学方程式,其中氧化剂是,还原剂是。8.4g铁粉参加反应,转移电子mol。
(2)玻璃管中石棉绒的作用是,实验开始时应先点燃,实验结束时应先熄灭。
(3)圆底烧瓶中盛装的水,该装置受热后的主要作用是;烧瓶底部应事先放置,其作用是。
(6分)有一包白色固体,可能含有CaCO3、Na2SO4、KNO3、CuSO4、BaCl2五种物质中的一种或几种。现进行如下实验:
⑴取少量固体粉末加到足量水中,得到白色沉淀,上层为无色清液。
⑵继续往其中加入足量稀硝酸,白色沉淀完全消失,并有气泡产生。
⑶取少量(2)中的溶液滴加Ba(NO3)2溶液,有白色沉淀生成,再加入稀硝酸,沉淀不溶。
根据上述实验现象判断:该白色固体中一定含有,一定不含有,可能含有。
用18.4mol/L的浓硫酸配制lmol/L稀硫酸100mL,其操作有以下各步:
①用量筒量取mL浓硫酸
②洗涤烧杯和玻璃棒2-3次,将洗涤液转入容量瓶中
③将稀释、冷却后的硫酸倒入100 mL容量瓶中
④将浓硫酸倒入盛有水的烧杯中稀释、冷却
⑤加水至液面接近刻度线1~2cm处,定容,摇匀
完成下列填空:
⑴第步操作中应用量筒量取mL浓硫酸;应选择mL量筒(填5、10或50)
⑵本实验用到的基本仪器已有烧杯、量筒、玻璃棒,还缺少的仪器是、、。(可以不填写满)
⑶正确的操作顺序是(用序号填写)。
⑷定容时,如果俯视刻度线,配制的硫酸浓度将偏 (填大或小)
现有X、Y、Z三种元素,已知有如下情况:
①X、Y、Z的单质在常温下均为气体。
② X的单质在Z的单质中燃烧,生成XZ,燃烧时火焰呈苍白色。
③ XZ极易溶于水,在水溶液中电离出X+和Z-。XZ的水溶液可使石蕊试液变红。
④ 两分子X的单质可与一分子Y的单质化合生成两分子X2Y,X2Y常温下为液体。
⑤ Z的单质溶于X2Y中,所得溶液具有漂白作用。
请完成下列问题:
(1)写出XZ和X2Y的化学式:XZ X2Y
(2)Z的单质溶于X2Y后,溶液起漂白作用的物质是 (写化学式)。
(3)写出X的单质在Z的单质中燃烧的化学方程式 。
(4)Z的单质能否与氢氧化钠溶液发生反应: (填“能”或“否”),若能,请写出反应的化学方程式: 。
(若不能反应,则此空不必填写)。
实验室用MnO2和浓盐酸共热来制氯气:MnO2 + 4HCl (浓) ="=" MnCl2 + Cl2↑+ 2H2O
⑴该反应中的还原产物是
⑵在反应方程式中标明电子转移的方向和数目
⑶如反应中转移了0.4mol电子,则产生的气体在标准状况下体积为