常温下,0.1 mol·L-1某一元酸(HA)溶液中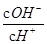 =1×10-10,下列叙述正确的是
=1×10-10,下列叙述正确的是
A.溶液中水电离出的c(H+)=10-10 mol·L-1
B.溶液中c(H+)+c(A-)=0.1 mol·L-1
C.与0.05 mol·L-1 NaOH溶液等体积混合,水的电离平衡向正向移动
D.上述溶液中加入一定量NaA晶体或加水稀释,溶液的c(OH-)均增大
向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是
| A.有铜无铁 | B.有铁无铜 | C.铁、铜都有 | D.铁、铜都无 |
下列有关电解质及氧化还原反应的叙述,正确的是
| A.某化合物溶于水导电,则该化合物为电解质 |
| B.NaCl溶液在电流作用下电离成Na+ 和Cl- |
| C.在氧化还原反应中,非金属单质一定是氧化剂 |
| D.元素由化合态变成游离态时,它可能被氧化,也可能被还原 |
在无色强酸性溶液中,下列各组离子能够大量共存的是
| A.NH4+、HCO3ˉ、Clˉ、K+ | B.Clˉ、Na+、NO3ˉ、Ca2+ |
| C.K+、Fe 2+、Clˉ、NO3ˉ | D.Cu2+、NH4+、SO42ˉ、Clˉ |
下列离子方程式的书写正确的是
| A.铁和稀硫酸反应:2Fe + 6H+= 2Fe 3+ + 3H2↑ |
| B.NaHCO3溶液与NaOH溶液反应:OHˉ+ HCO3ˉ = CO32ˉ+ H2O |
| C.钠和冷水反应:Na + 2H2O = Na++ 2OHˉ+ H2↑ |
| D.氯气通入水中:Cl2 + H2O = 2H++ Clˉ + ClOˉ |
以下关于物质的分类,正确的是
| 氧化物 |
酸 |
碱 |
盐 |
|
| A. |
Fe3O4 |
CH3COOH |
NH3·H2O |
(NH4)2SO4 |
| B. |
SO2 |
H2SO4 |
NaOH |
Na2O2 |
| C. |
CO |
HNO3 |
Cu2(OH)2CO3 |
FeSO4 |
| D. |
H2O |
NaHSO4 |
Ba(OH)2 |
Na2CO3 |