有稀硫酸和稀盐酸的混合液10mL,在此溶液中滴入0.25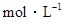 氢氧化钡溶液时(忽略溶液体积的变化),生成沉淀的量和溶液的pH变化与加入氢氧化钡溶液液体积的关系如图所示。求:
氢氧化钡溶液时(忽略溶液体积的变化),生成沉淀的量和溶液的pH变化与加入氢氧化钡溶液液体积的关系如图所示。求:
(1)滴定前盐酸和硫酸的物质的量浓度各为多少?
(2)在B点时的pH是多少?(已知lg2=0.3)(无计算过程不得分)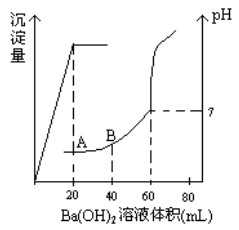
已知:2H2(g)+O2(g)==2H2O(g);△H = -483.6kJ/mol;H2(g)+  O2(g)==H2O(l);△H = -285.8kJ/mol,由此可知,在等温下蒸发45g液态水需吸收____________kJ的热量。
O2(g)==H2O(l);△H = -285.8kJ/mol,由此可知,在等温下蒸发45g液态水需吸收____________kJ的热量。
有一硝酸盐晶体,分子式为M(NO3)x·nH2O,经测定其摩尔质量为
242g / mol。取1.21 g此晶体溶于水,配制成100 mL溶液。将其置于电解池中用惰性材料为电极进行电解。经测定,当有0.01 mol电子通过电极时,溶液中全部金属离子即在阴极上析出,电极增重0.32 g。计算:(写出计算过程)
(1) 1.21 g此盐晶体的物质的量是多少?x值是多少?
(2) 求M的相对原子质量和n值。
氢氧燃料电池是将H2通入负极,O2通入正极而发生电池反应的,其能量转换率高。
(1)若电解质溶液为KOH,负极反应为_________________________________________
(2)若电解质溶液为硫酸,其正极反应为______________________,若在常温下转移2mol电子,可产生水质量为_________g。
(3)若用氢氧燃料电池电解由NaCl和CuSO4组成的混合溶液,其中c(Na+)=3c(Cu2+)=3mol·L—1,取该混合液100mL用石墨做电极进行电解,通电一段时间后,在阴极收集到1.12L (标准状况)气体。此时氢氧燃料电池中消耗H2和O2的物质的量各是多少?(写出计算过程)(保留2位小数)
已知:化学反应3Ag+ 4HNO3 (稀)= 3AgNO3+ NO↑+ 2H2O
(1)该反应的离子方程式为:_________________________________ ____
(2)当有32.4克银溶解时,反应生成的NO在标况下的体积是多少?
(3)当有0.2mol银溶解时,有多少克HNO3被还原?
标准状况下,H2和CO的混合气体共8.96L,测得其质量为6.0g,试计算此混合气体中H2和CO的质量和体积各为多少?