已知下列四个热化学方程式: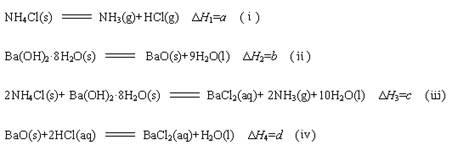
其中a、b、c 均大于0,HCl气体溶解于水,溶液温度升高。由此可知下列判断一定正确的是
| A.d<0 | B.c<2a+b-d | C.c=2a+b+d | D.c>2a+b-d |
根据下表 中有机物的分子式排列规律,判断空格中有机物的同分异构体数目是()
中有机物的分子式排列规律,判断空格中有机物的同分异构体数目是()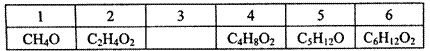

| A.2 | B.3 | C.4 | D.5 |
在25℃时向VmL pH=m的HNO3中,滴加pH=n的KOH溶液10 V mL时,溶液中NO3-物质的量恰好等于加入的K+的物质的量,则m+n的值为()
| A.13 | B.14 | C.15 | D.不能确定 |
设NA为阿伏加德罗常数的值,下列说法正确的是()
①lmol CH5+中含11NA个电子
②1mol —OH中含10NA个电子
③lmol C10H22分子中共价键总数为31NA
④0.4mol以任意比例混合的乙炔和乙醛气体在氧气中充分燃烧时,消耗氧分子数为NA
⑤1 L 1 mol/L苯酚钠溶液中含有C6H5O-的个数为NA
⑥28g乙烯和环丙烷组成的混合气体中含有3NA个氢原子
| A.①④ | B.②⑥ | C.③④ | D.②⑤ |
下列选用的相关仪器符合实验操作要求和现象的是()
下列离子方程式正确的是()
| A.少量金属钠放人醋酸中:CH3COOH+Na→CH3COO-+H2↑ |
| B.用银氨溶液检验乙醛中的醛基: CH3CHO+2Ag(NH3)2++2OH- 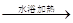 CH3COO-+NH4++3NH3+2Ag↓+H2O CH3COO-+NH4++3NH3+2Ag↓+H2O |
| C.苯酚钠溶液中通入少量CO2:CO2+H2O+2C6H5O-→2C6H5OH+2CO32- |
| D.少量醋酸滴入纯碱中:CO32-+2CH3COOH→2CH3COO-+CO2↑+H2O |