下面对氯气的叙述正确的是
| A.氯气可使湿润的红布条褪色,所以氯气具有漂白性 |
| B.氯气没有漂白性,但通入品红溶液中,品红褪色 |
| C.过量的铜在氯气中燃烧可生成氯化亚铜 |
| D.闻其气味时要小心的将集气瓶放在鼻孔下直接闻 |
在不同温度下,水溶液中c(H+)与c(OH﹣)有如图所示关系.下列条件关于离子共存说法中正确的是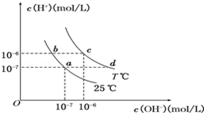
| A.a点对应的溶液中大量存在:Fe3+、Na+、Cl﹣、SO42﹣ |
| B.b点对应的溶液中大量存在:NH4+、Ba2+、OH﹣、I﹣ |
| C.c点对应的溶液中大量存在:Na+、Ba2+、Cl﹣、HCO3﹣ |
| D.d点对应的溶液中大量存在:Na+、K+、SO32﹣、Cl﹣ |
常温下,0.2mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示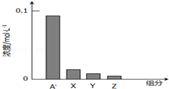
下列说法正确的是
| A.HA为强酸 |
| B.该混合液pH=7 |
| C.图中X表示HA,Y表示OH﹣,Z表示H+ |
| D.该混合溶液中:c(A-)+c(Y)=c(Na+) |
下列有关电解质溶液中粒子浓度关系正确的是
| A.pH=1的NaHSO4溶液:c(H+)=c(SO42﹣)+c(OH﹣) |
| B.含有AgCl和AgI固体的悬浊液:c(Ag+)>c(Cl﹣)=c(I﹣) |
| C.CO2的水溶液:c(H+)>c(HCO3﹣)=2c(CO32﹣) |
| D.含等物质的量NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O4﹣)+c(C2O42﹣)+c(H2C2O4)] |
已知常温时,Mg(OH)2的溶度积常数Ksp=5.6×10﹣12,取适量的MgCl2溶液,加入一定量的烧碱溶液达到沉淀溶解平衡,测得pH=12.0,则下列说法错误的是
| A.所得溶液中的c(H+)=1.0×10﹣12 mol•L﹣1 |
| B.所加的烧碱溶液的浓度为0.01mol/L |
| C.所得溶液中由水电离产生的c(OH﹣)=1.0×10﹣12mol•L﹣1 |
| D.所得溶液中的c(Mg2+)=5.6×10﹣8 mol•L﹣1 |
某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g)⇌2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如图所示。下列说法中正确的是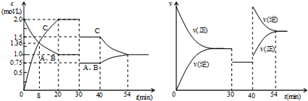
| A.30min时降低温度,40min时充入生成物C |
| B.0~8min内A的平均反应速率为0.08mol/(L•min) |
| C.反应方程式中的x=1,正反应为吸热反应 |
| D.20min~40min间该反应的平衡常数均为8 |