下列热化学方程式书写正确的是
A.SO2 + O2 2SO3ΔH =-196.6 kJ/mol 2SO3ΔH =-196.6 kJ/mol |
B.H2(g)+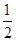 O2(g)= H2O( l ) ΔH =-285.8 kJ/mol O2(g)= H2O( l ) ΔH =-285.8 kJ/mol |
| C.2H2 ( g )+ O2 ( g )= 2H2O ( l )ΔH =+571.6 kJ/mol |
| D.C(s)+ O2 ( g )= CO2(g)ΔH =+393. 5 kJ/mol |
下列气体的主要成分不是甲烷的是 ()
| A.沼气 | B.天然气 | C.煤气 | D.坑道气 |
下图表示取1 mol己烯雌酚进行的四个实验,下列对实验数据的预测与实际情况吻合的是
| A.①中生成7 mol H2O | B.②中生成2 mol CO2 |
| C.③中最多消耗3 mo1 Br2 | D.④中最多消耗7 mol H2 |
“茶倍健”牙膏中含有茶多酚,其中没食子儿茶素(EGC)的结构如下图所示。关于EGC的下列叙述中正确的是( )
A.分子式为C15H12O7
B.EGC可在强碱的醇溶液中发生消去反应
C.1molEGC最多消耗6molNaOH
D.1molEGC可与4molBr2发生取代反应
一氧化碳、烯烃和氢气在催化剂作用下发生烯烃的醛化反应,又称羰基的合成,如由乙烯可制丙醛:CH2===CH2+CO+H2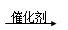 CH3CH2CHO。由丁烯进行醛化反应也可得到醛,在它的同分异构体中,属于醛的有( )
CH3CH2CHO。由丁烯进行醛化反应也可得到醛,在它的同分异构体中,属于醛的有( )
| A.2种 | B.3种 | C.4种 | D.5种 |
在核磁共振氢谱中出现两组峰,其两组峰的面积之比为3∶2的化合物是( )