Na2S2O3溶液跟稀H2SO4反应的化学方程式为:
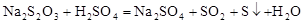 。下列各组实验中,溶液中最先变浑浊的是
。下列各组实验中,溶液中最先变浑浊的是
| |
反应 |
反 应 物 |
H2O |
|||
| |
温度 |
Na2S2O3 |
H2SO4 |
V |
||
| |
℃ |
v(mL) |
c(mol×L-1) |
v(mL) |
c(mol×L-1) |
(mL) |
| A |
10 |
5 |
0.1 |
10 |
0.1 |
5] |
| B |
10 |
5 |
0.1 |
5 |
0.1 |
10 |
| C |
30 |
5 |
0.1 |
5 |
0.1 |
10 |
下列叙述正确的是
| A.同温同压下,相同体积的气体,其分子数一定相等,原子数也一定相等 |
| B.任何条件下,等物质的量的甲烷(CH4)和一氧化碳,体积一定相同 |
| C.同温同压下的一氧化碳气体和氮气,若体积相等,则质量一定相等 |
| D.常温下,0.1mol/L的KI溶液中含有I-的物质的量为0.1mol |
下列溶液与20mL 1 mol·L_1 NaNO3溶液中NO3_物质的量浓度相等的是
| A.10 mL 1 mol·L—1 Mg(NO3)2溶液 | B.5 mL 0.8 mol·L—1 Al(NO3)3溶液 |
| C.10 mL 2 mol·L—1 AgNO3溶液 | D.10 mL 0.5 mol·L—1 Cu(NO3)2溶液 |
某化学兴趣小组用提取粗盐后的盐卤(主要成分为MgCl2)制备金属镁,其设计工艺流程如下,下列说法中,错误的是
| A.操作①中发生的反应为非氧化还原反应 | B.操作④中发生的反应为置换反应 |
| C.操作①是过滤 | D.操作②是蒸发浓缩冷却结晶 |
加入氧化剂能实现的变化是
| A.MnO2→MnSO4 | B.Na2O2→O2 |
| C.KI→KIO3 | D.AlCl3→Al(OH)3 |
为提纯下列物质(括号内物质为杂质),所选用的试剂和分离方法正确的是
| 物质 |
除杂试剂 |
分离方法 |
|
| A |
硝酸铜溶液(硝酸银) |
铜粉 |
结晶 |
| B |
NaCl溶液(CuCl2) |
NaOH溶液 |
萃取 |
| C |
乙醇(水) |
—— |
分液 |
| D |
铜粉(铁粉) |
稀盐酸 |
过滤 |