反应3Fe(s)+4H2O====Fe3O4(s)+4H2(g),在一可变容积的密闭容器中进行,试回答:
(1)增加Fe的量,其正反应速率 (填变快、不变、变慢,以下相同)。
(2)将容器的体积缩小一半,其正反应速率 ,逆反应速率 。
(3)保持体积不变,充入N2使体系压强增大,其正反应速率 ,逆反应速率 。
(4)保持压强不变,充入N2使容器的体积增大,其正反应速率 ,逆反应速率 。
(9分)已知B是常见金属单质,E为常见非金属单质,H常温下为无色液体。根据下列关系,试回答: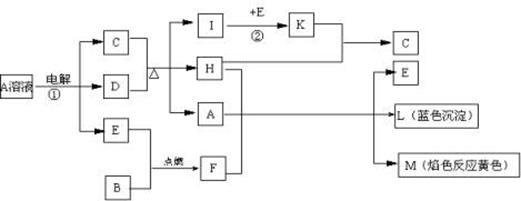
⑴L的化学式: F的电子式: 。
⑵反应①的离子方程式: 。
⑶反应②,工业上采取的反应条件: 。
⑷每生成1molK,反应放出98.3kJ热量,该反应的热化学方程式为:
。
质谱、红外光谱、核磁共振等物理方法已成为研究有机物的重要组成部分。
(1) 下列物质中,其核磁共振氢谱中给出的峰值只有一个的是
A.CH3CH3 B.CH3COOH C.CH3COOCH3 D.CH3OCH3
(2)化合物A和B的分子式都是C2H4Br2, A的核磁共振氢谱图如图所示,则A的结构简式为,
请预测B的核磁共振氢谱上应该有_______个峰(信号)。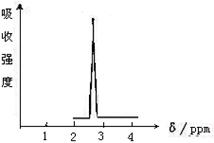
(3)化合物C中各原子数目比为:N(C):N(H):N(O)=1:2:1,对化合物C进行质谱分析可得到下图所示的质谱图,可得出其分子式为。若对其进行红外光谱分析,可得出其官能团为 (写名称)。确定化合物C的官能团时,你认为(填“有”或“没有”)必要进行红外光谱分析。写出化合物C与足量新制氢氧化铜反应的化学方程式:。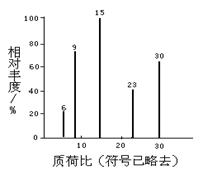
(9分)有关物质间有下图所示的转化关系。其中:A的浓溶液与单质B在加热时才发生反应①;A的稀溶液与足量B发生反应②。据此填写下列空白:
(1)反应④的现象是。
(2)写出反应②的离子方程式。
(3)根据题示信息判断,A的浓溶液和单质B加热时能否产生G,说明理由(写出化学方程式回答):
(每空2分,共10分)近年,国际原油价格大幅上涨,促使各国政府加大生物能生产,其中酒精汽油已进入实用化阶段。
(1)乙醇在铜或银作催化剂的条件下,可以被空气中的氧气氧化成X,X可发生银镜反应,请写出X被银氨溶液氧化的反应方程式(标出具体反应条件):______________________________________。
(2)乙醇可以与酸性重铬酸钾溶液反应,被直接氧化成Y,Y含有官能团的名称是________。在浓硫酸存在下加热,乙醇与Y反应可生成一种有香味的物质W,化学方程式为________________________________________。
(3)现有两瓶无色液体,分别盛有Y、W,只用一种试剂就可以鉴别,该试剂可以是____________________________________。
(4)现代石油化工采用银作催化剂,乙烯能被氧气氧化生成环氧乙烷( )该反应的原子利用率为100%,反应的化学方程式为___________。
)该反应的原子利用率为100%,反应的化学方程式为___________。
(14分)(1)金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题:
①NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点FeONiO (填“<”或“>”);
②铁有δ、γ、α三种同素异形体,各晶胞如下图,则δ、α两种晶胞中铁原子的配位数之比为。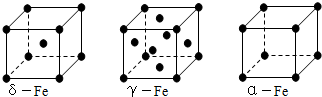
(2)元素金(Au)处于周期表中的第六周期,与Cu同族,一种铜金合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为;该晶体中,原子之间的强相互作用是;
(3)2007年诺贝尔物理学奖为法国科学家阿尔贝·费尔和德国科学家彼得·格林贝格尔共同获得,以表彰他们在巨磁电阻效应(CMR效应)研究方面的成就。某钙钛型复合氧化物如图所示,以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe等时,这种化合物具有CMR效应。

①用A、B、O表示这类特殊晶体的化学式:。
②已知La为+3价,当被钙等二价元素A替代时,可形成复合钙钛矿化合物La1-xAxMnO3(x<0.1),此时一部分锰转变为+4价。导致材料在某一温度附近有反铁磁—铁磁、铁磁—顺磁及金属—半导体的转变,则La1-xAxMnO3中三价锰与四价锰的物质的量之比为:。
③下列有关说法正确的是。
A.镧、锰、氧分别位于周期表f、d、p区
B.氧的第一电离能比氮的第一电离能大
C.锰的电负性为1.59,Cr的电负性为1.66,说明锰的金属性比铬强
D.铬的堆积方式与钾相同,则其堆积方式如图所示