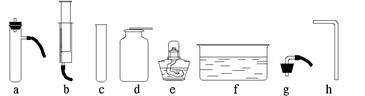
利用下列仪器进行实验(所有装置的气密性都已检查完毕)
(1)把过氧化氢溶液缓缓加入盛有二氧化锰的容器中制取并收集氧气,完成该实验你所选用的仪器有
(填字母)。写出发生反应的文字表达式 。这种方法与“把二氧化锰加入盛有过氧化氢溶液的试管中制氧气”相比有 的优点。
(2)某同学继续探究“红砖粉末是否也可以作过氧化氢分解的催化剂?”实验步骤和现象如下:
①他分别向两支试管中加入等质量等溶质质量分数的过氧化氢溶液,向其中一支试管加入一药匙红砖粉末,然后将两支试管中的气体导出通入水中比较产生气泡的快慢,发现加入红砖粉末的试管中反应较快。
②将反应较快的试管内固体过滤出来,洗涤、烘干、称量。
③用称量后的固体重复步骤①的实验,现象与步骤①完全相同。
试回答:步骤①中他除了选用试管外还用到上面列出的仪器有 (填字母)。步骤③的实验目的是 。该学生认为通过上述实验已证明红砖粉末可以作过氧化氢分解反应的催化剂,但老师认为该同学的实验还缺少一个关键步骤,请指出来 。
根据要求,写出下表相应的化学符号(化学用语)
| 名称 |
铝原子 |
两个氮分子 |
硝酸根离子 |
两个镁离子 |
| 化学符号 |
水是人类生活中不可缺少的物质。
(1)下列净水方法中,通常用于除去水中难溶性杂质的是① ,净水程度最高的是② 。
A.过滤 B.煮沸 C.蒸馏 D.吸附
(2)自来水厂常用二氧化氯(ClO2)消毒,其中氯元素的化合价为。
(3)小花同学设计了电解水简易装置,其中A、B电极由金属曲别针制成。
通电后的现象如图所示,则A是① 极。电解水的化学方程式为② 。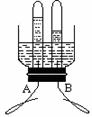
(4)自来水中含有少量Ca(HCO3)2等可溶性化合物,烧水时Ca(HCO3)2发生分解反应,生成难溶性的碳酸钙、水和二氧化碳,这就是壶中出现水垢的原因之一。请写出Ca(HCO3)2受热分解的化学方程式。
甲、乙两种固体物质的溶解度曲线如下图所示。现将两支分别装有甲、乙两物质饱和溶液的试管(底部均有少量未溶解的固体)浸入盛有水的烧杯中,再向烧杯中加入一定量的浓硫酸。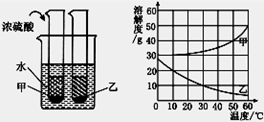
(1)50℃时,甲物质的溶解度是。
(2)30℃时,甲、乙两种物质的溶解度大小顺序是。
(3)加入浓硫酸后,装有甲、乙两物质的试管中固体量的变化是。除浓硫酸外,还可以加入物质,也会发生同样的变化。
(4)由此得出结论:。
2011年3月10日云南盈江县发生5.8级地震,震后当地生态环境和生活条件受到极大的破坏,水源受到一定程度的污染。灾区饮用水安全备受关注。
(1)向水样中加入明矾,经溶解、静置、(填操作名称),除去不溶性杂质,然后加入活性炭,利用其性除去异味,再杀菌消毒,得到生活用水。
(2)欲判断得到的生活用水是硬水还是软水,可加入进行检验,生活中常通过的方法降低水的硬度。
(3)当你身处在地震灾区时,水资源受到严重污染,必须经过净化处理后才能饮用。下列各项与水的净化过程无关的是(填标号)。
| A.吸附 | B.消毒 | C.电解 | D.过滤 |
小明做了一个趣味实验如图所示(装置气密性良好):
(1)写出A试管中发生反应的化学方程式;
反应类型是;
(2)待试管冷却至室温,在水中取下胶塞,试管中液面上升(如图B所示)。
其原因是。