今有如下三个热化学方程式:
H2(g)+1/2O2(g)=H2O(g); ΔH=aKJ·mol-1,
H2(g)+1/2O2(g)=H2O(l); ΔH=bkJ·mol-1,
2H2(g)+O2(g)=2H2O(l); ΔH=ckJ·mol-1,
关于它们的下列表述正确的是
| A.它们都是吸热反应 | B.a、b和c均为正值 |
| C.a=b | D.2b=c |
下列说法不正确的是()
| A.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小; |
| B.沉淀反应中常加过量的沉淀剂,其目的是使沉淀完全; |
C.对于Al(OH)3(s) Al(OH)3(aq) Al(OH)3(aq)  Al3++3OH-,前者为溶解平衡,后者为电离平衡; Al3++3OH-,前者为溶解平衡,后者为电离平衡; |
| D.除去溶液中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2的溶解度比MgCO3大 |
常温下,将甲酸和氢氧化钠溶液混合,所得溶液pH=7,则此溶液中()
| A.c(HCOO-)>c(Na+) | B.c(HCOO-)<c(Na+) |
| C.c(HCOO-)=c(Na+) | D.无法确定c(HCOO-)与c(Na+)的关系 |
下列说法正确的是()
| A.增大压强,活化分子百分数增大,化学反应速率一定增大 |
| B.升高温度,活化分子百分数增大,化学反应速率可能增大 |
| C.加入反应物,使活化分子百分数增大,化学反应速率增大 |
| D.一般使用催化剂可以降低反应的活化能,增大活化分子百分数,增大化学反应速率 |
下列操作中,能使电离平衡H2O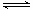 H++OH-,向右移动且溶液呈酸性的是()
H++OH-,向右移动且溶液呈酸性的是()
| A.向水中加入NaHSO4溶液 | B.向水中加入Al2(SO4)3固体 |
| C.向水中加入Na2CO3溶液 | D.将水加 热到100℃,使pH=6 热到100℃,使pH=6 |
现有常温时pH=1的某强酸溶液10mL,下列操作能使溶液的pH变成2的是()
A. 加入10mL 0.01mol·L-1的NaOH溶液 加入10mL 0.01mol·L-1的NaOH溶液 |
B.加入10mL 的水进行稀释 |
| C.加水稀释成100mL | D.加入10mL 0.01mol·L-1的盐酸溶液 |