0.1mol/LNa2S2O3溶液与0.1mol/LH2SO4溶液各5mL和10mL水混合,反应速率为v1mol/(L·s);0.2mol/L Na2S2O3溶液与0.2mol/LH2SO4溶液各5mL和20mL水混合,反应速率为v2 mol/(L·s);则v1和v2的关系是
| A.大于 | B.小于 | C.等于 | D.不能确定 |
下列有关说法正确的是(NA为阿伏加德罗常数)
| A.1.00molNaCl中含有NA个NaCl分子 |
| B.欲配制1.00L,1.00mol.L-1的NaCl溶液,可将 58.5gNaCl溶于 1.00L水 |
| C.1.12L Cl2含有1.7NA个质子 |
| D.1molCl2与足量的铁反应,转移的电子数为2NA |
已知还原性:Cl—<Br—<Fe2+<I—<SO2,由此判断下列反应必然发生的是
①2Fe3++SO2+2H2O=2Fe2++SO +4H+②I2+SO2+2H2O=4H++SO
+4H+②I2+SO2+2H2O=4H++SO +2I—
+2I—
③2Fe2++I2=2Fe3++2I—④2Br—+4H++SO =SO2↑+Br2+2H2O
=SO2↑+Br2+2H2O
| A.①② | B.②③ | C.③④ | D.①④ |
据报道,科学家开发出了利用太阳能分解水的新型催化剂。下列有关水分解过程的能量变化示意图正确的是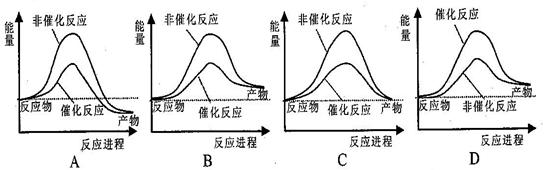
下列推断正确的是
| A.SiO2是酸性氧化物,能与NaOH溶液反应 |
| B.Na2O、Na2O2组成元素相同,与 CO2反应产物也相同 |
| C.CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 |
| D.新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 |
甲溶液的pH是4,乙溶液的PH是5,甲溶液与乙溶液的c(H+)之比为
| A.10:1 | B.1:10 |
| C.2:1 | D.1:2 |