固定和利用CO2,能有效地利用资源,并减少空气中的温室气体.工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的化学方程式是:
CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)+49.0kJ
某科学实验将6mol CO2和8mol H2充入一容积为2L的密闭容器中,测得H2的物质的量随时间变化如图中实线所示(图中字母后的数字表示对应的坐标):
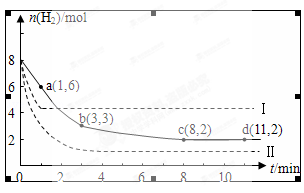
回答下列问题:
(1)由图分析,在下列时间段内反应速率最快的时间段是 (填答案编号)
a.0~1min b.1~3min c.3~8min d.8~11min
(2)该反应在0~8min内CO2的平均反应速率是 mol/(L•min).
(3)仅改变某一条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示.与实线相比,曲线Ⅰ改变的条件可能是 ,曲线Ⅱ改变的条件可能是
若实线对应条件下平衡常数为K,曲线Ⅰ对应条件下平衡常数为K1,曲线Ⅱ对应条件下平衡常数为K2,则K、K1和K2的大小关系是
(4)下列表述能表示该反应已达平衡的是 (填答案编号)
a.容器内压强不再改变 b.容器内气体的密度不再改变
c.容器内气体平均摩尔质量不再改变 d.容器内各物质的物质的量相等
(1)写出下列物质在水溶液中的电离方程式
NaHCO3________________________Fe2(SO4)3___________________________
(2)写出下列反应的离子方程式
稀硫酸与氢氧化钡溶液混合_______________________
碳酸钙与稀盐酸混合_______________________
氧化铜与稀硫酸混合_______________________
选择下列实验方法分离物质,将合理的分离方法的字母填在横线上。
A 萃取分液 B 加热分解 C 结晶 D 分液 E 蒸馏 F 过滤
(1)________分离饱和食盐水和沙子的混合物
(2)________从硝酸钾和氯化钠的混合溶液中获得硝酸钾
(3)________分离水和苯的混合物
(4)________分离四氯化碳(沸点为76.75 ℃)和甲苯(沸点为110.6 ℃)的混合物
(5)在“粗盐提纯”的实验中,多次用到玻璃棒,在溶解、过滤、蒸发三个步骤中,玻璃棒所起的作用分别是 ; ;________。
有一固体混合物,可能由Na2CO3、Na2SO4、CuSO4、NaCl等混合而成,为检验它们,做了以下实验:
①将固体混合物溶于水中,搅拌后得无色透明溶液;
②往此溶液中滴加硝酸钡溶液,有白色沉淀产生;
③过滤,将沉淀物置于稀硝酸中,发现沉淀全部溶解。
根据上述实验事实,回答下列问题:
(1)原固体混合物中一定含有的物质是________,一定不含有的物质是________,可能含有的物质是________(以上空格均填写化学式)。对可能含有的物质,可采用向滤液中滴加________溶液的方法来检验。
(2)写出步骤③中的离子方程式:_____________________________。
完成下列化学方程式,并写出离子方程式。
(1)硫酸铜和氯化钡化学反应方程式:________________________,
离子方程式为:_________________________。
(2)锌和硫酸铜溶液反应化学反应方程式:________________________,
离子方程式为:_________________________。
(3)碳酸钙和稀盐酸反应化学反应方程式:________________________,
离子方程式为:_________________________。
(4)碳酸氢钠和稀硝酸反应化学反应方程式:________________________,
离子方程式为:_________________________。
以下为中学化学中常见的几种物质:
①Cu ②NaCl ③NaHSO4④CO2⑤H2SO4⑥酒精 ⑦CaCO3⑧BaSO4⑨NaOH
请按下列分类标准回答问题。
(1)属于电解质的是________。(2)能电离出H+的是________,属于酸的是________。(3)属于碱的是________。(4)难溶的盐是________。(5)非电解质的是________。