某化学兴趣小组同学以TiO2和CCl4为原料在实验室制取液态TiCl4,装置如图所示。
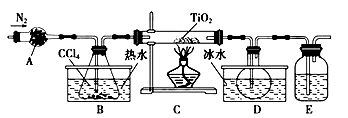
有关信息如下:
①反应原理:TiO2(s)+CCl4(g)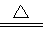 TiCl4(g)+CO2(g)
TiCl4(g)+CO2(g)
②反应条件:无水无氧且加热
③有关物质性质如下表:

请回答下列问题:
(1)B中盛有CCl4的仪器名称是__________,仪器A装的试剂不可能是(填序号)_____________。
a.碱石灰 b.无水硫酸铜 c.氧化钙 d.烧碱
(2)实验开始前的操作包括:①组装仪器,②_____________,③加装药品,④____________,⑤最后点燃酒精灯。第④步的目的是___________________。
(3)装置E中的试剂是_____________;E装置____________(填“能”或“不能”换成A装置,理由是_______________________。
(4)欲分离D中的液态混合物,所采用操作的名称是__________________。
(5)TiCl4还可由TiO2和焦炭、氯气在加热下反应制得,同时有气体生成,请设计实验方案探究气体的成分。____________________。
次硫酸氢钠甲醛(NaHSO2·HCHO·2H2O)俗称吊白块,不稳定,120℃时会分解,在印染、医药以及原子能工业中有广泛应用。以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如图: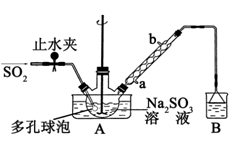
步骤1:在三颈烧瓶中加入一定量Na2SO3和水,搅拌溶解,缓慢通入SO2,至溶液pH 约为4,制得NaHSO3溶液.
步骤2:将装置A 中导气管换成橡皮塞.向烧瓶中加入稍过量的锌粉和一定量甲醛溶液,在80~90℃下,反应约3h,冷却至室温,抽滤;
步骤3:将滤液真空蒸发浓缩,冷却结晶.
(1)装置B 的烧杯中应加入的溶液是_________________;冷凝管中冷却水从__________(填“a”或“b”)口进水。
(2)A中多孔球泡的作用是_________________;
(3)写出步骤2中发生反应的化学方程式_________________;
(4)步骤3中在真空容器中蒸发浓缩的原因是是防止温度过高使产物分解,也防止_______________;
(5)为了测定产品的纯度,准确称取2.0g样品,完全溶于水配成100mL溶液,取20.00mL所配溶液,加入过量碘完全反应后(已知I2不能氧化甲醛,杂质不反应),加入BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重得到白色固体0.466g。[M(NaHSO2·HCHO·2H2O)=154g/mol]
①如何检验沉淀是否洗净_____________________________。
②则所制得的产品的纯度为_____________。
亚氯酸钠(NaClO2)是重要漂白剂,探究小组开展如下实验,回答下列问题:
实验Ⅰ:制取NaClO2晶体按如下图装置进行制取。
已知:NaClO2饱和溶液在低于38℃时析出NaClO2•3H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
(1)装置C的作用是 ;
(2)已知装置B中的产物有ClO2气体,则装置B中反应的方程式为 ;装置D中反应生成NaClO2的化学方程式为 ;反应后的溶液中阴离子除了ClO2﹣、ClO3﹣、Cl﹣、ClO﹣、OH﹣外还可能含有的一种阴离子是 ;检验该离子的方法是 ;
(3)如果撤去D中的冷水浴,可能导致产品中混有的杂质是 ;
实验Ⅱ:样品杂质分析与纯度测定
(4)测定样品中NaClO2的纯度.测定时进行如下实验:
①准确称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO2-+4I-+4H+=2H2O+2I2+Cl-);将所得混合液配成250 mL待测溶液。
②移取25.00 mL待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol·L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得平均值为V mL(已知:I2+2S2O32-=2I-+S4O62-)。
达到滴定终点时的现象为________________。该样品中NaClO2的质量分数为____________(用含m、c、V的代数式表示)。
某化学兴趣学习小组设计实验探究金属M与浓硫酸反应的气体产物。
[提出假设]假设1:气体产物只有SO2;假设2:_______________。
[实验设计]为了探究金属M与浓硫酸反应产物,设计如图实验装置:一定量的浓硫酸与金属M反应。
(1) 检查上述装置气密性的一种方法是:关闭分液漏斗的活塞,在H装置后面连上一根导管,然后 ,则证明装置的气密性良好。
(2)若B瓶里品红溶液褪色,E、F和G中都无明显现象。反应后硫酸盐中金属显+2价。写A中发生反应的化学方程式: ;
(3)若假设2正确,则可观察到:F管中 ;G干燥管里 。
[实验反思] 为了进一步探究金属M成分和气体组分,进行如下实验:
称取11.2g金属M放入装置A中,加入一定量的浓硫酸,反应结束后,B瓶里品红溶液褪色,金属没有剩余,拆下G并称重,G增重0.9g。
(4)为了观察溶液颜色,实验完毕后,需要稀释烧瓶里溶液。稀释烧瓶里溶液的操作方法: 。
(5)将稀释后的溶液分装甲、乙试管,向甲试管里滴加KSCN溶液,溶液变红色;向乙试管里滴加酸性高锰酸钾溶液,振荡,溶液紫色褪去。如果烧瓶溶液中金属离子浓度相等,则气体成分及物质的量为 。试写出烧瓶里发生反应的总化学方程式 。
某研究性学习小组,为了探究过氧化钠的强氧化性,设计了如图的实验装置。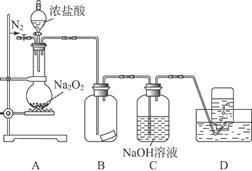
实验步骤及现象如下:
①检查装置气密性后,装入药品并连接仪器。
②缓慢通入一定量的N2后,将装置D连接好(导管末端未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸,反应剧烈,产生黄绿色气体。
③一段时间后,将导管末端伸入集气瓶中收集气体。装置D中收集到能使带火星的木条复燃的无色气体。
④反应结束后,关闭分液漏斗的活塞,再通入一定量的N2,至装置中气体无色。
回答下列问题:
(1)装置B中的湿润的红色纸条褪色,证明A中反应有 (填化学式)生成。若B中改放湿润的淀粉KI试纸,仅凭试纸变蓝的现象不能证明上述结论,请用离子方程式说明原因 。
(2)装置C的作用是 。
(3)甲同学认为O2是Na2O2被盐酸中的HCl还原所得。乙同学认为此结论不正确,他可能的理由为:
① ② 。
(4)实验证明,Na2O2能与干燥的HCl反应,完成并配平该化学方程式。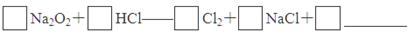
该反应 (填“能”或“不能”)用于实验室快速制取纯净的Cl2,理由是 (要求答出一个要点即可)。
某化学研究小组在使用FeSO4溶液与NaOH溶液制备Fe(OH)2沉淀过程中观察到生成的白色沉淀迅速转变为灰绿色,最后变为红褐色,该小组针对绿色物质展开研究。
【查阅文献】
| 文献名称 |
有关Fe(OH)2的描述 |
| 《大学普通化学(下册)》 |
白色沉淀,易被氧化成微绿色Fe3(OH)8 |
| 《化学教育》 |
白色沉淀,在冷水中易形成绿色的水合物Fe(OH)2·nH2O,热水中不易形成水合物 |
(1)写出Fe(OH)2在空气中被氧化为Fe(OH)3的化学方程式______________;
【提出假设】假设一:绿色物质是Fe(OH)2·nH2O;
假设二:________________;·······
【实验探究】针对上述假设与假设二,展开实验研究:
| 实验序号 |
实验步骤 |
实验现象 |
| 一 |
①在试管中加入20mL蒸馏水,加热煮沸,滴苯液封 ②保持较高温度,使用长滴管伸入液面下依次挤入一滴饱和FeSO4 溶液、一滴NaOH溶液 |
出现白色絮状沉淀,并能保持一段时间 |
| 二 |
①在试管中加入20mL蒸馏水 ②加入一滴饱和FeSO4 溶液、一滴NaOH溶液 |
出现白色沉淀,迅速转变为灰绿色,最后变为红褐色 |
| 三 |
①在试管中加入20mL蒸馏水,加热煮沸,滴苯液封 ②恢复室温后,使用长滴管伸入液面下依次挤入一滴饱和FeSO4 溶液、一滴NaOH溶液 |
出现白色沉淀,迅速转变为绿色沉淀 |
(1)实验室保存FeSO4溶液常需加入 (填化学式,下同),为检验某FeSO4溶液是否变质,可向溶液中加入______________;
(2)由实验一与实验 (填实验序号)的现象可推断假设 可能成立。
(3)为了进一步探究假设二是否成立,小组成员进行如下实验,请完成下表:
试剂:蒸馏水、NaOH溶液、苯、FeSO4溶液、氧气
| 实验步骤 |
实验现象与结论 |
| ①在试管中加入20mL蒸馏水,加热煮沸,滴苯液封 ② ③ |
若沉淀中出现绿色的迹象,则假设二成立; 若沉淀中没有出现任何绿色的迹象,则假设二不成立。 |