在一个容积固定的密闭容器中,发生反应:CO(g)+2H2(g) CH3OH(g)ΔH<0。第2 min时只改变一个条件,反应情况如下表:
CH3OH(g)ΔH<0。第2 min时只改变一个条件,反应情况如下表:
| 时间 |
c(CO)/mol/L |
c(H2)/mol/L |
c(CH3OH)/mol/L |
| 起始 |
1 |
3 |
0 |
| 第2 min |
0.8 |
2.6 |
0.2 |
| 第4 min |
0.4 |
1.8 |
0.6 |
| 第6 min |
0.4 |
1.8 |
0.6 |
下列说法不正确的是
A.第4 min至第6 min该化学反应处于平衡状态
B.第2 min时,如果只改变某一条件,则改变的条件可能是降低温度
C.第2 min时,如果只改变某一条件,则改变的条件可能是使用催化剂
D.第6 min时,其他条件不变,如果升高温度,正反应速率增大
已知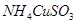 与足量的10mol/L硫酸液混合微热,产生下列现象:①有红色金属生成②产生刺激性气味的气体③溶液呈现蓝色。据此判断下列说法正确的是
与足量的10mol/L硫酸液混合微热,产生下列现象:①有红色金属生成②产生刺激性气味的气体③溶液呈现蓝色。据此判断下列说法正确的是
| A.反应中硫酸作氧化剂 |
B.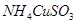 中硫元素被氧化 中硫元素被氧化 |
| C.刺激性气味的气体是氨气 |
D.1mol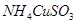 完全反应转移0.5mol电子 完全反应转移0.5mol电子 |
右图表示在某溶液中滴加Ba(OH)2溶液时,生成的沉淀的物质的量随Ba(OH)2溶液的体积变化关系。该溶液的成分可能是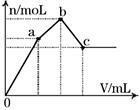
| A.NH4Al(SO4)2 |
| B.KAl(SO4)2 |
| C.Al2(SO4)3 |
| D.Na2SO4与NaAlO2组成的混合物 |
下列各组离子能在指定溶液中,大量共存的是
①无色溶液中:K+、Cl-、Na+、MnO4-、NO3-、SO42-
②使pH=11的溶液中:CO32-、Na+、AlO2-、NO3-、S2-、SO32-
③水电离的H+浓度c(H+)=10-12 mol·L-1的溶液中:Cl-、HCO3-、NO3-、NH4+、S2O32-
④加入Mg能放出H2的溶液中:Mg2+、NH4+、Cl-、K+、SO42-
⑤使甲基橙变红的溶液中:Fe3+、MnO4-、NO3-、Na+、SO42-
⑥酸性溶液中:Fe2+、Al3+、NO3-、I-、Cl-、S2-
| A.①②⑤ | B.①③⑥ | C.②④⑤ | D.①②④ |
NA为阿伏加德罗常数的数值,下列说法正确的是
| A.7.2g CaO2晶体中阴离子和阳离子总数为0.3NA |
B.反应3H2(g)+N2(g)  2NH3(g)ΔH=-92 kJ/mol放出热量9.2kJ时,转移电子0.6NA 2NH3(g)ΔH=-92 kJ/mol放出热量9.2kJ时,转移电子0.6NA |
| C.0.1 mol/L NH4Cl溶液中Cl-离子数目为0.1NA |
| D.0.1 mol H2O2分子中含极性共价键数目为0.3NA |
用右图表示的一些物质或概念间的从属关系中不正确的是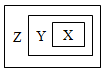
| X |
Y |
Z |
|
| A |
苯的同系物 |
芳香烃 |
芳香族化合物 |
| B |
胶体 |
分散系 |
混合物 |
| C |
置换反应 |
氧化还原反应 |
离子反应 |
| D |
碱性氧化物 |
金属氧化物 |
氧化物 |