一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g) 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示: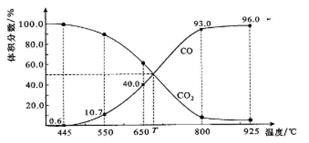
已知:气体分压(P分)=气体总压(P总)×体积分数。下列说法正确的是
| A.550℃时,若充入惰性气体,v正,v逆均减小,平衡不移动 |
| B.T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动 |
| C.650℃时,反应达平衡后CO2的转化率为25.0% |
| D.925℃时,用平衡分压代替平衡浓度表示的化学平衡常数KP=24.0P总 |
已知:2H2(g)+O2(g)=2H2O(l) ;
;
CH4 (g)+2O2(g)=CO2+2H2O(l) ;
;
现有H2与CH4的混合气体112L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3241.6KJ。则原混合气体中H2与CH4的物质的量之比是(()
| A.2∶3 | B.1∶3 | C.1∶1 | D.1∶4 |
在容积可变的密闭容器中,2molN2和6molH2在一定条件下反应,达到平衡时,H2的转化率为40%,则平衡时氨气的体积分数接近于()
| A.10% | B.15% | C.20% | D.25% |
反应CO(g)+2H2(g) CH3OH(g)过程中的能量变化情况如图所示,曲线I和曲线II分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是()
CH3OH(g)过程中的能量变化情况如图所示,曲线I和曲线II分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是()
| A.反应物的总能量大于生成物的总能量 |
| B.加入催化剂,该反应的△H变小 |
| C.如果该反应生成液态CH3OH,则△H变大。 |
| D.该反应的△H =+91 kJ/mol |
某温度下,容积一定的密闭容器中进行如下可逆反应:

 ;
; ,下列叙述正确的是()
,下列叙述正确的是()
| A.加入少量W,逆反应速率增大 |
B.平衡后加入X,上述反应的 增大 增大 |
| C.升高温度,平衡逆向移动 |
| D.混合气体密度不变,不能作为反应达到平衡的标志 |
在1 L密闭容器中,把1 mol A和1 mol B混合发生如下反应:3A(g) + B(g) xC(g) + 2D(g),当反应达到平衡时,生成0.4 mol D,并测得C的平衡浓度为0.4 mol·Lˉ1,下列叙述中不正确的是()
xC(g) + 2D(g),当反应达到平衡时,生成0.4 mol D,并测得C的平衡浓度为0.4 mol·Lˉ1,下列叙述中不正确的是()
| A.x的值为2 | B.A的转化率为40% |
| C.B的平衡浓度为0.8 mol·Lˉ1 | D.D的体积分数为20% |