实验:①0.1 mol·L-1 AgNO3溶液和0.1 mol·L-1 NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c;②向滤液b中滴加0.1 mol·L-1 KI溶液,出现浑浊;③向沉淀c中滴加0.1 mol·L-1 KI溶液,沉淀变为黄色。下列分析不正确的是
A.浊液a中存在沉淀溶解平衡:AgCl(s) Ag+(aq)+Cl-(aq) Ag+(aq)+Cl-(aq) |
| B.滤液b中不含有Ag+ |
| C.③中颜色变化说明AgCl转化为AgI |
| D.实验可以证明AgI比AgCl更难溶 |
工业上可用硫酸铝与硫磺焙烧制备氧化铝:2Al2(SO4)3+3S 2Al2O3+9SO2↑,下列有关说法中正确的是()
2Al2O3+9SO2↑,下列有关说法中正确的是()
| A.反应中Al2(SO4)3被氧化 |
| B.Al2 (SO4)3、Al2O3均含有离子键和共价键 |
| C.5.1 g Al2O3含有9.03×1022个阴离子 |
| D.该反应中,每转移0.3 mol电子生成5.04 L SO2 |
下列说法正确的是()
| A.工业上冶炼铝常用焦炭还原氧化铝 |
| B.CO2、 NO2或SO2都会导致酸雨的形成 |
| C.光导纤维、聚乙烯、油脂都是高分子化合物 |
| D.可通过加水吸收后再用半透膜渗析的方法分离PM2.5微粒与可溶性吸附物 |
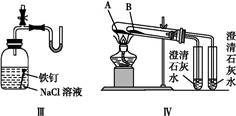
利用下列实验装置,不能完成实验目的的是()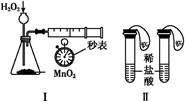
| A.利用装置Ⅰ进行H2O2分解反应速率的定量测定 |
| B.利用装置Ⅱ进行碳酸氢钠与碳酸钠的检验 |
| C.利用装置Ⅲ证明铁生锈时空气参与反应 |
| D.利用装置Ⅳ进行碳酸氢钠与碳酸钠稳定性强弱比较 |
一定量碳酸氢钠与过氧化钠的混合物在密闭体系中充分加热后,排出气体,测出固体残留物中有两种成分,则该固体组成中一定含有()
| A.NaHCO3、Na2CO3 | B.NaOH、Na2CO3 |
| C.Na2O2、Na2CO3 | D.Na2O2、NaOH |
下列关于钠与水反应的说法不正确的是()
①将小块钠投入滴有石蕊试液的水中,反应后溶液变红
②将钠投入稀盐酸中,钠先与水反应,后与盐酸反应
③将两小块质量相等的金属钠,一块直接投入水中,另一块用铝箔包住,在铝箔上刺些小孔,然后投入水中,两者放出的氢气质量相等
| A.只有①② | B.只有③ | C.只有②③ | D.①②③ |