某无色透明溶液能与铝粉反应放出H2,则此溶液中可能存在
| A.OH-、Ba2+、Cl-、Na+ | B.H+、Cl-、Na+、SO42- |
| C.H+、Cu2+、[Al(OH)4]-、SO42- | D.H+、Ba2+、Mg2+、NO3- |
下列盐溶液中,加入BaCl2溶液生成白色沉淀,再加入稀HNO3振荡,白色沉淀不消失的是( )
| A.Na2SO3 | B.K2CO3 |
| C.Na3PO4 | D.Na2SiO3 |
下列叙述正确的是( )
| A.酸均不能与酸性氧化物反应 |
| B.玻璃、陶瓷、水泥容器都不能贮存氢氟酸 |
| C.石灰抹墙、水泥砌墙过程的硬化原理相同 |
| D.石灰窑、玻璃熔炉出来的气体的主要成分不相同 |
SiO2跟C有下面两个反应:
SiO2+2C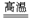 Si+2CO↑,SiO2+3C
Si+2CO↑,SiO2+3C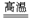 SiC+2CO↑,当SiO2与C的物质的量之比为4∶10时,硅元素的存在形式为( )
SiC+2CO↑,当SiO2与C的物质的量之比为4∶10时,硅元素的存在形式为( )
| A.Si | B.SiC | C.Si和SiC | D.SiO2 |
在含amol Ca(OH)2的石灰水中,缓慢地通入bmol CO2气体,实验过程中开始白色沉淀增多,后又部分消失,如果CO2充分被吸收,则最后得到的白色沉淀质量是( )
| A.100(2a-b)g | B.100(b-a)g |
| C.100(a-b)g | D.100(2b-a)g |
把9.2g Na和4.2g Si同时投入适量水中,在标准状况下产生H2的体积是( )
| A.2.8 L | B.5.6 L |
| C.11.2 L | D.22.4 L |