二氧化硫和氮的氧化物是常用的工业原料,但也是大气的主要污染物。综合治理基污染是环境化学当前的重要研究内容之一。
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)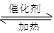 2SO3(g)△H=-198kJ•mol-1
2SO3(g)△H=-198kJ•mol-1
某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如图所示.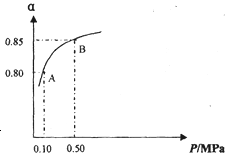
根据图示回答下列问题:
①将2.0mol SO2和1.0mol O2置于10L密闭容器中,反应达平衡后,体系总压强为0.10MPa.该反应的平衡常数等于 _________________。
②平衡状态由A变到B时.平衡常数K(A)____________K(B)(填“>”、“<”或“=”)
(2)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
若用标准状况下4.48L CH4还原NO2至N2,放出的热量为:____________kJ
(6分)按要求写出相应的方程式:电离方程式:
(1)H2S:____________________________。
(2)NH4HSO4____________________________。
水解反应的离子方程式:
(1)CuSO4____________________________。
(2)Na2CO3____________________________。
(3)AlCl3+Na2S____________________________。
浓度均为0.1mol/L的8种溶液:①HNO3②H2SO4③CH3COOH④Ba(OH)2⑤NaOH⑥CH3COONa⑦KCl⑧NH4Cl其溶液的pH由小到大的顺序是 。
有5 种 短周期元素的原子序数按E、D、B、A、C的顺序依次增大;A、C同周期,B、C同主族;A与B可形成离子化合
短周期元素的原子序数按E、D、B、A、C的顺序依次增大;A、C同周期,B、C同主族;A与B可形成离子化合 物A2B,A2B中所有粒子的电子数相同,且电子总数为30;D和E可形成4核10电子的分子。试回答下列
物A2B,A2B中所有粒子的电子数相同,且电子总数为30;D和E可形成4核10电子的分子。试回答下列 问题:
问题:
(1)写出五种元素的名称:ABCDE。
(2)用电子式表示离子化合物A2B的形成过程:
(3)写出下列物质的电子式:
D元素形成的单质;B与E形成的化合物;
A、B、E 形成的化合物;D、E形成的化合物
形成的化合物;D、E形成的化合物
不同的物质不仅组成不同、结构不同 ,所包含的也不同。放热反应的宏观表现是,其微观表现是。
,所包含的也不同。放热反应的宏观表现是,其微观表现是。
一切化学反应除了有质量的 变化外,还伴随着的变化,它们分别遵循定律和定律。能量变化通常主要表现为的变化,即或者。
变化外,还伴随着的变化,它们分别遵循定律和定律。能量变化通常主要表现为的变化,即或者。