水热法制备Fe3O4纳米级颗粒的反应为3Fe2+ +2S2O32-+O2 +xOH-=Fe3O4+S4O62-+2H2O,下列说法中,不正确的是
| A.每生成1mol Fe3O4,反应转移的电子总数为4mol |
| B.Fe2+和S2O32-都是还原剂 |
| C.1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为1/3mol |
| D.x=4 |
一定条件下,某容积不变的密闭容器内存在下列平衡:2HI(g) H2(g)+I2(g);则下列有关说法正确的是()
H2(g)+I2(g);则下列有关说法正确的是()
| A.如仅仅改变浓度这一条件,使得体系颜色加深,则上述平衡在条件改变之后的移动方向无法判断:即可以正移或逆移,还可以不移动 |
| B.如改变体系温度,体系颜色一定发生变化 |
| C.继续充入HI气体,则HI的转化率将减小 |
| D.温度不变时,当体系颜色变浅,则正反应速率和逆反应速率都将减小 |
在A+B(s) C的反应中,若增大压强或降低温度,B的转化率均增大,则反应体系应是()
C的反应中,若增大压强或降低温度,B的转化率均增大,则反应体系应是()
| A.A是固体、C是气体,正反应吸热 | B.A是气体、C是液体,正反应放热 |
| C.A是气体、C是气体,正反应放热 | D.A是气体、C是气体,正反应吸热 |
下图为某化学反应的速率与时间的关系示意图。在t1时刻升高温度或增大压强,速率的变化都符合示意图的反应是()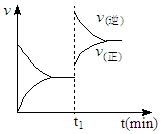
| A.2SO2(g)+O2(g) ⇌2SO3(g);ΔH<0 |
| B.4NH3(g)+5O2(g) ⇌4NO(g)+6H2O(g);ΔH<0 |
| C.H2(g)+I2(g) ⇌2HI(g); ΔH>0 |
| D.C(s)+H2O(g) ⇌CO(g)+H2(g);ΔH>0 |
在一定温度下、一定体积条件下,能说明下列反应达到平衡状态的是()
A.反应2SO2(g)+O2(g) 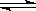 2SO3(g) 容器内的密度不随时间变化 2SO3(g) 容器内的密度不随时间变化 |
B.反应A2(g)+B2(g) 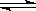 2AB(g)容器内的总压强不随时间变化 2AB(g)容器内的总压强不随时间变化 |
C.反应N2+3H2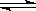 2NH3容器内气体平均相对分子质量不随时间变化 2NH3容器内气体平均相对分子质量不随时间变化 |
D.反应4A(s)+3B(g)  2C(g)+D(g)容器内气体平均相对分子质量不随时间变化 2C(g)+D(g)容器内气体平均相对分子质量不随时间变化 |
将 4 mol A 气体和 2 mol B 气体在 2 L 的容器中混合并在一定条件下发生如下反应:2A(气)+B(气)=2C(气),若经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1 ,现有下列几种说法:
①用物质 A 表示的反应的平均速率为 0.3 mol·L-1·s-1
②用物质 B 表示的反应的平均速率为 0.6 mol·L-1·s-1
③ 2 s 时物质 A 的转化率为70%
④ 2 s 时物质 B 的浓度为 0.7 mol·L-1其中正确的是()
| A.①③ | B.①④ | C.②③ | D.③④ |