右图是KNO3和NaCl的溶解度曲线。下列说法正确的是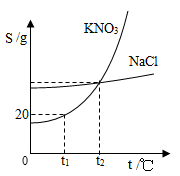
| A.t1℃时,100gKNO3饱和溶液中含有20g KNO3 |
| B.NaCl的溶解度不受温度的影响 |
| C.温度高于t2℃时,KNO3的溶解度大于NaCl的溶解度 |
| D.t2℃时,KNO3的饱和溶液和NaCl的饱和溶液中溶质的质量分数不一定相等 |
甲、乙、丙、丁4种化合物均含有2种或3种元素,分子中均含18个电子。甲是气态氢化物,在水中分步电离出两种阴离子。下列推断合理的是
| A.某钠盐溶液含甲电离出的阴离子,则该溶液显碱性,只能与酸反应 |
| B.乙和甲中同种元素的质量分数相等,则乙中含有化合价为-1的元素 |
| C.丙与氧气的摩尔质量相同,则丙一定仅由两种元素组成 |
| D.丁中含有第二周期ⅣA族元素,则丁一定是甲烷的同系物 |
常温下已知两种一元弱酸HX和HY,如果向NaX溶液中通入少量CO2气体生成HX和NaHCO3;往NaY溶液中通入少量CO2生成HY和Na2CO3。下列有关叙述正确的是
| A.酸性由强至弱:HX>HY>H2CO3 |
| B.结合H+的能力:Y->CO32->X->HCO3- |
| C.溶液碱性:NaX>Na2CO3>NaY>NaHCO3 |
| D.NaX溶液中通入足量CO2后的离子浓度:c(Na+)>c(HCO3-)>c(X-)>c(OH-)>c(H+) |
室温下,下列各组离子在指定溶液中一定能大量共存的是
| A.pH=12的溶液中:AlO2-、Na+、SO 42-、SO32- |
| B.水电离出的c(H+)=10-12mol/L的溶液中:K+、Na+、SO 42-、AlO2- |
| C.能与铝反应生成氢气的溶液中:Mg2+、Na+、Cl-、NO3- |
| D.c(H+)=0.10mol/L的溶液中:CH3COO-、NH4+、Cl-、Na+ |
下列实验过程和过程中涉及的离子反应方程式肯定正确的是
A.除去硫酸铜溶液中的硫酸亚铁以最终制备胆矾晶体:2Fe2+ + Cl2 2Fe3+ + 2Cl- 2Fe3+ + 2Cl- |
B.检验丙烯醛CH2=CHCHO中含有碳碳双键:CH2=CHCHO + Br2 CH2Br-CHBr-CHO CH2Br-CHBr-CHO |
C.向Ba(OH)2溶液中加入过量的NH4HSO4溶液:Ba2+ + 2OH-+ NH4+ + H+ + SO42- BaSO4↓ + NH3·H2O + H2O BaSO4↓ + NH3·H2O + H2O |
D.向含有0.1 mol溶质的硫酸亚铁稀溶液中加入7.8 g Na2O2:4Na2O2 + 4Fe2+ + 6H2O 4Fe(OH)3 ↓+ 8Na+ + O2↑ 4Fe(OH)3 ↓+ 8Na+ + O2↑ |
从某些性质看,NH3和H2O,NH4+和H3O+,OH-和NH2-,N3-和O2-两两相当,据此判断下列反应方程式正确的是
①2Na + 2NH3 2NaNH2 + H2↑ ②CaO + 2NH4Cl
2NaNH2 + H2↑ ②CaO + 2NH4Cl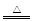 CaCl2 + 2NH3↑+ H2O
CaCl2 + 2NH3↑+ H2O
③3Mg(NH2)2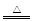 Mg3N2 + 4NH3↑ ④NH4Cl + NaNH2
Mg3N2 + 4NH3↑ ④NH4Cl + NaNH2 NaCl + 2NH3(l)
NaCl + 2NH3(l)
| A.仅①正确 | B.②④正确 | C.全部正确 | D.①②④正确 |