碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
| 开始沉淀 |
2.3 |
7.5 |
3.4 |
| 完全沉淀 |
3.2 |
9.7 |
4.4 |

回答下列问题:
(1)如何加快废铁屑的溶解,写出两种办法_____________________。
(2)加入少量NaHCO3的目的是调节pH在_________________范围内。
(3)反应Ⅱ中加入NaNO2的目的是__________________。
(4)碱式硫酸铁溶于水后生成的Fe(OH)2+离子可部分水解生成Fe2(OH)42+聚合离子,该水解反应的离子方程式为_________________。
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为_______________。
A.氯水 B.KSCN溶液 C.酸性KMnO4溶液 D.NaOH溶液
(6)为测定含Fe2+和Fe3+溶液中铁元素的总含量,实验操作如下:准确量取20.00mL溶液于带塞锥形瓶中,加入足量H2O2,调节pH<2,加热除去过量H2O2;加入过量KI充分反应后,再用 0.1000mol/L Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。
已知:2Fe3++2I-═2Fe2++I2 I2+2S2O32-═2I-+S4O62-
则溶液中铁元素总含量为g/L。若滴定前溶液中H2O2没除尽,所测定的铁元素的含量将会____________(填“偏高”“偏低”“不变”)。
在一定温度下的某容积可变的密闭容器中,建立下列化学平衡:
C(s)+H2O(g)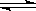 CO(g)+H2(g) , 试分析和回答下列问题:
CO(g)+H2(g) , 试分析和回答下列问题:
(1)可认定上述可逆反应在一定条件下已达到化学平衡状态的是。
| A.体系的压强不再发生变化 |
| B.v正(CO)=v逆(H2O) |
| C.生成n mol CO的同时生成n mol H2 |
| D.1 mol H-H键断裂的同时断裂2 mol H-O键 |
(2)若上述化学平衡状态从正反应方向开始建立,达到平衡后,缩小平衡体系的体积,则容器内气体的平均摩尔质量将(填“不变”、“变小”、“变大”)。
(3)若上述化学平衡状态从正、逆两反应方向同时建立[即起始时同时投放C(s)、H2O(g)、CO(g)、H2(g)],达到平衡后,试讨论:
① 容积内气体混合物的平均摩尔质量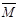 的取值范围是。
的取值范围是。
② 若给平衡体系加压,请参照起始投放的气体物质的平均摩尔质量(设定为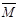 1),分别给出
1),分别给出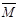 的变化:(填“增大”、“减小”、“不变”)
的变化:(填“增大”、“减小”、“不变”)
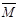 1的取值 1的取值 |
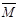 的变化 的变化 |
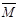 1<12 1<12 |
|
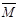 1=12 1=12 |
不变 |
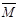 1>12 1>12 |
现用物质的量的浓度为a mol/L的标准盐酸去测定V mL NaOH溶液的物质的量浓度,请填写下列空白:
(1)酸式滴定管用蒸馏水洗净后,装入标准液前还应该进行的操作是。
(2)下图是酸式滴定管中液面在滴定前后的读数: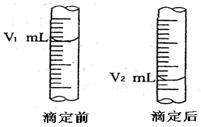
则c (NaOH) = (表达式)。
(3)若在滴定前滴定管尖嘴部分留有气泡,滴定后滴定管尖嘴部分气泡消失,则测定的NaOH物质的量浓度会。(填“偏大”、“偏小”或不影响)
请你给出化合物A—K的结构简式。其中D的相对分子质量为100。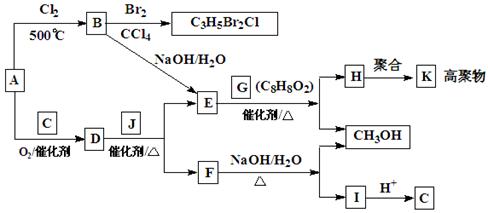
A 、B 、C、D、E、
F 、G、H、I 、G 、K .
黄酮醋酸类化合物具有黄酮类化合物抗菌、消炎、降血压、保肝等多种生理活性和药理作用,尤其是近年来报道此类化合物具有独特抗癌活性。下面的方法采用对甲酚作为起始原料,通过一系列反应合成化合物黄酮F(化学式为C18H12O2NBr),为黄酮醋酸的前体化合物)。其进一步水解即得黄酮醋酸。合成路线如下: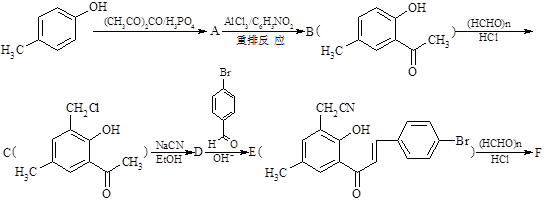
对于F,分子中存在3个六元环,E和F在化学式上相差2个H原子。
⑴ 请写出A、D、F的结构简式A、D、F。
⑵ B有多种同分异构体,请写出一种含苯环、羰基和一个手性碳原子的同分异构体:。
⑶ A可能发生的化学反应的类型有、。(写出二种)
⑷ 化合物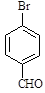 的系统名称是。
的系统名称是。
⑸ D经过水解后的产物可通过缩聚反应生成高分子化合物,写出该缩聚反应的方程式。
(8分)现有A、B两种链状饱和一元醇的混合物0.1 mol,其质量为4.6g。已知①A和B碳原子数均不大于4,且A<B;②A和B分子中均不含有支链,且都能被催化氧化生成醛。
(1)混合物中A可能的分子式;B可能的分子式。
(2)若n(A):n(B)=1:1时, A的名称;B的名称。
(3)若n(A):n(B)≠1:1时,A的结构简式为; B的结构简式为; 则 n(A)∶n(B)= 。