下列各组离子中,在溶液里不能大量共存的是
| A.K+、Na+、OH-、 SO42- | B.Fe3+、K+、Cl-、 SCN- |
| C.Na+、K+、CO32-、NO3- | D.H+、Al3+、SO42-、NO3- |
下列有关化学用语表示正确的是
| A.HClO的结构式:H—Cl—O |
B.羟基的电子式: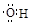 |
| C.NaHCO3在水中的电离方程式:NaHCO3=Na++H++CO32- |
| D.异丙醇的结构简式:CH3CH2CH2OH[来 |
下列说法错误的是
| A.使用可降解塑料聚二氧化碳,能减少白色污染 |
| B.实施“煤改气”、“煤改电”等清洁燃料改造工程,有利于保护环境 |
| C.雷雨过后感觉到空气清新是因为空气中产生了少量的二氧化氮 |
| D.通常所说的三大有机合成材料是指塑料、合成纤维、合成橡胶 |
常温下,1L pH=3的H2SO4溶液与下列溶液混合,其说法正确的是
| A.与等体积pH=11的氨水混合后所得溶液pH小于7 |
| B.与pH=3的CH3COOH溶液混合后所得溶液pH小于3 |
| C.与等浓度的CH3COONa溶液混合后所得溶液pH一定小于7 |
| D.与10L Ba(OH)2溶液恰好完全反应,则Ba(OH)2溶液的pH一定等于10 |
用下列装置进行相应实验,能达到实验目的的是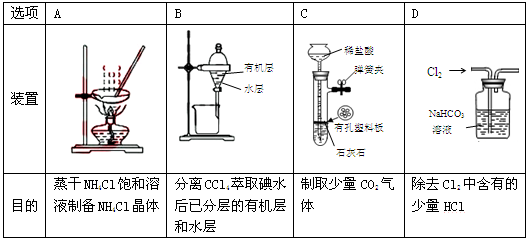
下列各组物质之间不能通过一步就能实现a→b→c→d→a转化的是
| a |
b |
c |
d |
|
| A |
Cu |
CuSO4 |
Cu(OH)2 |
Cu2O |
| B |
N2 |
NO2 |
HNO3 |
NO |
| C |
CH3OH |
HCHO |
HCOOH |
HCOOCH3 |
| D |
Na |
Na2O2 |
NaOH |
NaCl |