研究发现,硝酸越稀,还原产物中氮元素的化合价越低。某同学取适量的铁铝合金与足量很稀的硝酸充分反应,没有气体放出。在反应结束后的溶液中,逐滴加入4 mol/L NaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。下列说法不正确的是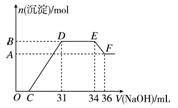
| A.OC段离子反应方程式为H++OH-===H2O |
| B.溶液中n(NH4+)=0.012 mol |
| C.溶液中结合OH-能力最强的离子是H+,最弱的离子是Al3+ |
| D.欲测定F点沉淀的质量,实验步骤是:过滤、洗涤、干燥、称量 |
下列各组混合物中,能用分液漏斗进行分离的是
| A.苯和CCl4 | B.溴和CCl4 | C.酒精和水 | D.汽油和水 |
相同容积的四个密闭容器中进行同样的可逆反应:2X(g)+Y(g) 3W(g)+2Z(g)起始时四个容器所装X、Y的量分别为:甲(X:2mol,Y:1mol)乙(X:1mol,Y:1mol)丙(X:2mol,Y:2mol)丁(X:1mol,Y:2mol)在相同温度下,建立平衡时,X或Y的转化率大小关系为
3W(g)+2Z(g)起始时四个容器所装X、Y的量分别为:甲(X:2mol,Y:1mol)乙(X:1mol,Y:1mol)丙(X:2mol,Y:2mol)丁(X:1mol,Y:2mol)在相同温度下,建立平衡时,X或Y的转化率大小关系为
| A.X的转化率为:甲<丙<乙<丁 | B.X的转化率为:甲<乙<丙<丁 |
| C.Y的转化率为:甲>丙>乙>丁 | D.Y的转化率为:丁>乙>丙>甲 |
在体积恒定的密闭容器中,充入3molA和1molB发生反应:3A(g)+B(g)  xC(g),达平衡后,C在平衡混合气中的体积分数为w。若维持温度不变,按1.2molA、0.4molB、0.6molC为起始物质,达平衡后压强不变,C的体积分数仍为w,则x的值为
xC(g),达平衡后,C在平衡混合气中的体积分数为w。若维持温度不变,按1.2molA、0.4molB、0.6molC为起始物质,达平衡后压强不变,C的体积分数仍为w,则x的值为
A.1 B.2 C.4 D.1或4
在一定温度下,向容积固定的密闭容器中充入amolC(g),发生如下可逆反应:2A(g)+B(g)  2C(g) △H <0。达平衡后再向容器中充入 amolC(g),再达平衡后,与原平衡比较,下列叙述正确的是
2C(g) △H <0。达平衡后再向容器中充入 amolC(g),再达平衡后,与原平衡比较,下列叙述正确的是
| A.平均相对分子质量减小 | B. C的转化率增大 |
| C. C的质量分数增大 | D.反应热大于原来的2倍 |
在恒温、恒容的条件下,有反应2A(g)+2B(g) C(g)+3D(g),现从两条途径分别建立平衡。途径Ⅰ:A、B的起始浓度均为2mol/L;途径Ⅱ:C、D的起始浓度分别为2 mol/L和6mol/L。则以下叙述不正确的是
C(g)+3D(g),现从两条途径分别建立平衡。途径Ⅰ:A、B的起始浓度均为2mol/L;途径Ⅱ:C、D的起始浓度分别为2 mol/L和6mol/L。则以下叙述不正确的是
A.两途径最终达到平衡时,体系内混合气的平均相对分子质量不同
B.两途径最终达到平衡时,体系内混合气的百分组成相同
C.达平衡时,途径Ⅰ的反应速率v(A)小于途径Ⅱ的反应速率v(A)
D.达平衡时,途径Ⅰ所得混合气的密度为途径Ⅱ所得混合气密度的1/2