下列实验设计方案或判断中正确的是
| A.加入足量铜粉后,搅拌、可过滤可除去Cu(NO3)2溶液中混有的AgNO3 |
| B.通过装有NaOH溶液的确洗气瓶来除去CO2中混有的HCl气体 |
| C.某无色未知溶液中加入BaCl2溶液,有白色沉淀,可推断溶液中的一定含有SO42- |
| D.未知溶液中加入盐酸产生使澄清石灰水变浑浊的气体,则溶液中一定大量含CO32- |
用NA表示阿伏加德罗常数,下列叙述中正确的是()
| A.标准状况下,22.4L乙醇完全燃烧后生成CO2的分子数为2NA |
| B.56g的铁发生氧化还原反应,一定失去3NA个电子 |
| C.标准状况下,22.4L氟气中所含氟原子数为2NA |
D.0.1mol· 稀硫酸中含有 稀硫酸中含有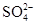 离子数为0.1NA 离子数为0.1NA |
下列反应中,属于加成反应的是()
A. |
B. |
C.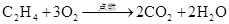 |
D. |
下列关于有机化合物的说法不正确的是()
| A.鸡蛋清中加浓硝酸微热后变黄 |
| B.将苯滴入溴水中,振荡后水层接近无色 |
| C.蛋白质水解能得到氨基酸 |
| D.苯与乙烯都能使高锰酸钾溶液褪色 |
下列离子方程式书写正确的是()
A.将过量的二氧化碳通入氢氧化钠溶液: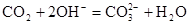 |
B.氯化铝溶液中加入过量浓氨水: |
C.氯化铁溶液中加入铁粉: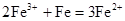 |
D.碳酸钙和盐酸反应: |
汽车尾气中的有毒气体NO和CO,在一定条件下可发生反应生成N2和CO2。下列关于此反应的说法中,正确的是()
| A.减小压强能增大反应速率 |
| B.增大压强能减小反应速率 |
| C.使用适当的催化剂能增大反应速率 |
| D.升高温度对反应速率无影响 |